МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
Метод молекулярных орбиталей исходит из того, что каждую молекулярную орбиталь представляют в виде алгебраической суммы (линейной комбинации) атомных орбиталей. Например, в молекуле водорода в образовании МО могут участвовать только 1 s атомные орбитали двух атомов водорода, которые дают две МО, представляющие собой сумму и разность атомных орбиталей 1 s 1 и 1 s 2 – МО± = C 11 s 1 ± C 21 s 2.
Поскольку ядра во взаимодействующих атомах водорода одинаковы, то и вклад атомных орбиталей будет одинаковым, что обеспечивается равенством коэффициентов, с которыми s -орбитали участвуют в линейной комбинации (C 1 = C 2 = C). Поскольку должно выполняться требование, что сумма квадратов коэффициентов при АО равна 1, то имеем 2 C 2 = 1, откуда
Электронная плотность этих двух состояний пропорциональна |MO±|2. Поскольку в молекуле водорода взаимодействие возможно только по оси молекулы, то каждая из MO± может быть переобозначена как σсв = 1 s 1 + 1 s 2 и σ* = 1 s 1 – 1 s 2 и названа соответственно связывающей (σсв) и разрыхляющей (σ*) молекулярными орбиталями Переход двух электронов на МО σсв способствует понижению энергии системы; этот энергетический выигрыш равен энергии связи между атомами в молекуле водорода H–H. Даже удаление одного электрона с МО (σсв)2 c образованием (σсв)1 в молекулярном ионе При большом расстоянии r 12 их энергия будет мало отличаться от энергий АО 1 s 1 и 1 s 2. При некотором Согласно методу МО порядок (кратность) связи n определяется полуразностью числа связывающих N св и разрыхляющих N разэлектронов:
При нулевой кратности связи, как в случае He2, молекула не образуется.
|


 Опуская этот нормировочный множитель, запишем две молекулярные орбитали как сумму и разность АО атомов водорода:
Опуская этот нормировочный множитель, запишем две молекулярные орбитали как сумму и разность АО атомов водорода:
 оставляет эту систему более устойчивой, чем отдельно существующие атом H и ион H+.
оставляет эту систему более устойчивой, чем отдельно существующие атом H и ион H+. энергия σсв достигнет минимума и будет соответствовать энергии связи E св молекулы H–H. При дальнейшем сближении ядер энергии σсв и σ* начинают повышаться, поскольку силы отталкивания начинают преобладать над силами притяжения. В молекуле ядра колеблются вблизи равновесного расстояния
энергия σсв достигнет минимума и будет соответствовать энергии связи E св молекулы H–H. При дальнейшем сближении ядер энергии σсв и σ* начинают повышаться, поскольку силы отталкивания начинают преобладать над силами притяжения. В молекуле ядра колеблются вблизи равновесного расстояния 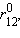 соответствующего минимуму энергии
соответствующего минимуму энергии  .
.



