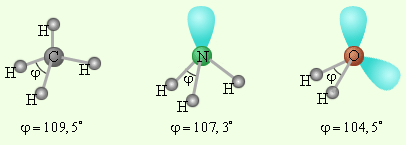(МВС) иначе называют теорией локализованных электронных пар, поскольку в основе метода лежит предположение, что химическая связь между двумя атомами осуществляется с помощью одной или нескольких электронных пар, которые локализованы преимущественно между ними. Так же, как и в ММО, в образовании химической связи принимают участие валентные электроны. Волновая функция, описывающая состояние электронов, образующих связь, называется локализованной орбиталью (ЛО).
При образовании ковалентной химической связи происходит перекрывание волновых функций электронов (электронных орбиталей), при этом связь будет тем прочнее, чем больше это перекрывание.
Ковалентная химическая связь располагается в том направлении, в котором возможность перекрывания волновых функций электронов, образующих связь будет наибольшей
МВС достаточно хорошо, предсказывает валентные возможности атомов и геометрию образующейся молекулы. Последнее обстоятельство связано с так называемой гибридизацией атомных орбиталей. двухэлектронные двухцентровые химические связи, образованные за счет АО в разных энергетических состояниях, имеют одинаковую энергию. Так, Be*(2 s 11 p 1), B*(2 s 12 p 2), C*(2 s 12 p 3) образуют за счет s - и p -орбиталей соответственно две, три и четыре связи, а потому одна из них должна быть прочнее других.

|
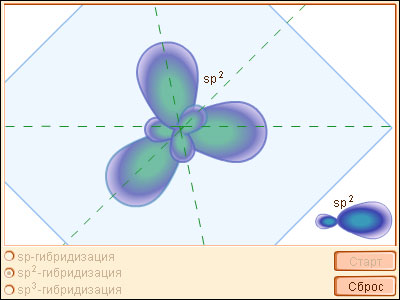
| Модель 3.4. Гибридизация орбиталей
|
Согласно представлению о гибридизации, химические связи образуются смешанными –
гибридными орбиталями (ГО), которые представляют собой линейную комбинацию АО данного атома (
s - и
p -АО Be, B, C), обладают одинаковыми энергией и формой, определенной ориентацией в пространстве (симметрией). Так
s - и
p -орбитали дают две
sp -ГО, расположенные под углом 180° друг относительно друга.

|
| Рисунок 3.16
s -орбиталь + p -орбиталь и две sp -ГО
|
В молекуле CH
4 гибридные орбитали из четырех АО углерода (одной
s и трех
p), называются
sp 3-орбиталями, они полностью эквивалентны энергетически и пространственно направлены к вершинам тетраэдра.
Таким образом, когда один атом образует несколько связей, а его валентные электроны принадлежат разным орбиталям (s и p; s, p и d), для объяснения геометрии молекул в МВС необходимо привлекать теорию гибридизации атомных орбиталей. Основные положения теории следующие:
- Введение гибридных орбиталей служит для описания направленных локализованных связей. Гибридные орбитали обеспечивают максимальное перекрывание АО в направлении локализованных σ-связей.
- Число гибридных орбиталей равно числу АО, участвующих в гибридизации.
- Гибридизуются близкие по энергии валентные АО независимо от того, заполнены они в атоме полностью, наполовину или пусты.
- В гибридизации участвуют АО, имеющие общие признаки симметрии.
гибридные орбитали дают молекулы с углами 180°, 120°, 109°28', 90°. Это правильные геометрические фигуры. Такие молекулы образуются, когда все периферические атомы в многоэлектронной молекуле (или ионе) одинаковы и их число совпадает с числом гибридных орбиталей. Однако, если число гибридных орбиталей больше числа связанных атомов, то часть гибридных орбиталей заселена электронными парами, не участвующими в образовании связи, –
несвязывающими или
неподеленными электронными парами.
В качестве примера молекулы NH3 и H2O. Атомы азота и кислорода склонны к sp 3-гибридизации. У азота на sp 3-ГО, поимо трех связывающих пар электронов, образующих связь с тремя атомами водорода, остается одна несвязывающая пара. Именно она, занимая одну sp 3-ГО, искажает угол связи H–N–H до 107,3°. В молекуле H2O таких несвязывающих пар две, и угол H–O–H равен 104,5° (рис. 3.17).
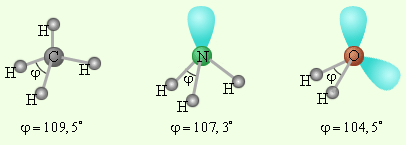
|
| Рисунок 3.17
Несвязывающие электронные пары и углы связи в молекулах NH3и H2O в сравнении с молекулой CH4
|