Белки злаков
Модульная единица 3
Среднее содержание белков в злаках составляет от 7 до 17%. Причем наиболее белковистой является пшеница, наименьшее количество белка – в рисе и кукурузе (7 – 9%). Белки неравномерно распределяются между морфологическими частями зерна. Основное их количество приходится на эндосперм (65 – 75%); на зародыш до 22%, на алейроновый слой до 15,5%. В эндосперме белки распределены также неравномерно, концентрация их снижается по мере продвижения к центру. Центральная часть эндосперма содержит мало белка (7 – 9%).Распределение белка по частям зерновки зависит от вида культуры, ее сорта и почвенно-климатических условий выращивания. Биологическая ценность белков злаков различна. В таблице 4.1 представлено содержание незаменимых аминокислот в суммарных зерновых белках. Анализируя аминокислотный состав суммарных белков различных злаковых культур с точки зрения состава эталонного белка для питания людей (ФАО, 1973) следует отметить, что все они, за исключением гречихи и овса, бедны лизином (2,2 – 3,3%), а за исключением риса, гречихи и сорго – изолейцином. Для белков пшеницы, сорго, ячменя и ржи характерно относительно небольшое количество метионина (1,6 – 1,7мг/100 г белка). Белки пшеницы к тому же содержат недостаточное количество треонина (2,6%), а белки кукурузы – триптофана (0,6%). Наиболее сбалансированными по аминокислотному составу являются овес и гречиха. По содержанию валина зерно гречихи может быть приравнено к молоку, по лейцину – к говядине, фенилаланину – к молоку и говядине. По содержанию триптофана зерно гречихи не уступает продуктам животного происхождения. Белки зерна гречихи хорошо сбалансированы по содержанию незаменимых аминокислот. Исключение составляют серосодержащие аминокислоты, которых недостаточно в белках зерна гречихи.
Таблица 4.1 Содержание незаменимых аминокислот в суммарных зерновых белках и потребность в них человека (%)
При изучении белков зерновых культур используют метод извлечения их фракций по растворимости (альбумины, глобулины, проламины и глютелины), предложенный американским исследователем Осборном. Альбумины растворяются в воде. Из водных растворов альбумины осаждают высаливанием при насыщении солями (сульфатом аммония и др.). Альбуминный комплекс зерна в основном состоит из ферментов. Глобулины растворяются в водных растворах различных солей (применяют обычно 5 – 10%-ный раствор NaCI). В чистой воде они нерастворимы. Для выделения глобулинов из солевого раствора применяют диализ с помощью полупроницаемых мембран или разбавляют большим количеством воды. Глобулины составляют большую часть семян бобовых культур. Проламины – наиболее характерные белки для зерна большинства злаковых культур. Они растворяются в 60 – 80%-ном растворе этанола. К проламинам относят глиадин из зерна пшеницы и ржи (составная часть клейковины), гордеин – ячменя, зеин – кукурузы, авенин – овса. Глютелины растворяются в растворах щелочей (0,1 – 0,2%). Они мало изучены, так как их трудно выделить в чистом виде. Наиболее изучены глютелин зерна пшеницы (составная часть клейковины), оризенин риса и глютелин кукурузы. Разделение протеинов по растворимости носит условный характер. Современными методами установлена гетерогенность каждой из названных белковых фракций. Каждая из них состоит из нескольких, во многих случаях из многих десятков различных белков, имеющих некоторые общие свойства. В таблице 4.2 приводится процентное содержание белковых фракций в зерновых культурах.
Таблица 4.2 Содержание белковых фракций в зерне злаковых
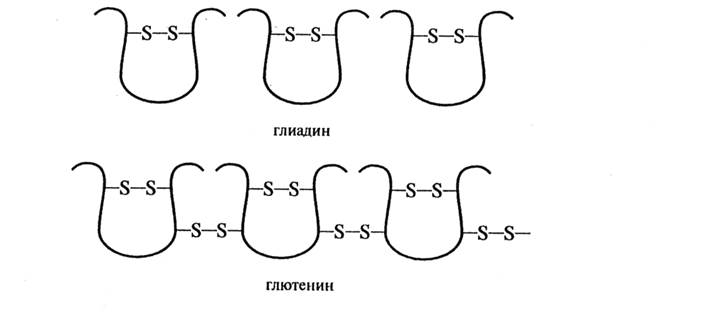
В состав белков входят и так называемые склеропротеины (нерастворимые белки), содержащиеся в оболочках и периферических слоях зерна. Особенностью белков данной фракции является прочное соединение с лигнино-полисахаридным комплексом. Склеропротеины выполняют структурную функцию и мало доступны для пищеварения. Наряду с белками в зерне содержится небелковый азот (0,7 – 12,9% от общего азота), включающий свободные аминокислоты (50 – 60%), пептиды, нуклеотиды и др. Количество небелкового азота изменяется в зависимости от степени зрелости, выравненности и прорастания зерна. Для всех альбуминов характерно высокое содержание важнейших незаменимых аминокислот, в том числе лизина, треонина, метионина, изолейцина и триптофана, а из других аминокислот – глютаминовой и аспарагиновой. Наиболее высоким содержанием лизина выделяются суммарные альбумины овса, риса и проса, более низким – пшеницы, ячменя, сорго и ржи. В альбуминах ржи, сорго, риса много метионина; в альбуминах овса, кукурузы, риса – изолейцина; в альбуминах пшеницы, кукурузы, сорго, риса - триптофана. Треонин часто бывает дефицитной аминокислотой для злаковых культур, в альбуминах ячменя, ржи и овса его содержание высокое, в альбуминах пшеницы – самое низкое. Глобулины злаковых также отличаются относительно высоким содержанием лизина. Вместе с тем у пшеницы, проса, сорго, риса и овса эта фракция белков лизином представлена беднее, чем альбуминовая тех же видов. Альбуминовая и глобулиновая фракции представляют собой гетерогенные комплексы белков. Альбумины и глобулины играют существенную роль во всех проявлениях жизнедеятельности зерна. Характерной особенностью проламинов является высокое содержание глутаминовой кислоты (13,7 – 43,3%), пролина (6,3 – 19,3). Проламины отличаются низким содержанием лизина, которого очень мало в проламинах пшеницы, сорго и ржи. Еще беднее этой аминокислотой зеин кукурузы и паницин проса: в них обнаружены лишь следы лизина. Низкое содержание лизина в проламинах и высокий процент этой фракции в белках большинства злаков – основная причина их несбалансированности по лизину. Проламины также бедны треонином и триптофаном. Относительно богат триптофаном паницин проса. Триптофан практически отсутствует в зеине кукурузы и кафирине сорго. Пеструю картину дает содержание в проламинах отдельных культур серосодержащих аминокислот (цистина, цистеина и метионина). В глиадине пшеницы найдено 1,9% цистина, в секалине ржи 2%, авенине 4,4%. В паницине проса и оризенине риса обнаружено немного цистина, а в кафирине сорго – лишь его следы. Значительные расхождения по содержанию в проламинах злаков лейцина. В проламинах большинства зерен злаковых культур наблюдается высокий уровень лейцина, прежде всего в зеине, кафирине и оризенине (17 – 18). Мало лейцина содержат секалин,гордеин и паницин. Внешние факторы мало изменяют аминокислотный состав проламинов – при разных условиях азотного питания они имеют тот же аминокислотный состав. Проламины, как и другие белковые фракции, представляют собой сложную смесь белковых компонентов. Для проламинов характерна видовая и сортовая специфичность их компонентного состава. Эта особенность положена в основу геномного анализа пшеницы для определения подлинности и сортовой чистоты семян по электрофоретическому спектру глиадинов. Разработана карта белков, при помощи которой различают, какими хромосомами контролируется синтез отдельных глиадиновых компонентов у мягкой пшеницы. Значительный удельный вес в общем белковом фонде зерна злаковых приходится на фракцию глютелинов. Особенность глютелинов в том, что по аминокислотному составу они занимают промежуточное положение между проламинами и глобулинами. Содержание лизина в них больше, чем в проламинах: в глютенине пшеницы, ржи и ячменя составляет (соответственно) 1,7; 2,3 и 4%, в глютелине кукурузы, сорго, ржи и проса – 2,4; 3,1; 4; овса – 5%. Глютелины отличаются от проламинов более высоким содержанием аргинина, гистидина, гликокола. По аминокислотному составу белок глютелинов сбалансирован лучше, чем у проламинов. Более подробно изучены состав и свойства глютелинов пшеницы в виде изолированной фракции и в составе клейковины – глиадиново-глютенинового комплекса. Содержание лизина в глютенинах пшеницы, как и в глиадинах, невысокое. На долю обеих фракций в пшеничной муке приходится более 80% белка и в целом зерне 50 – 60%. В связи с этим белки пшеницы бедны лизином. Полноценность зерна риса по аминокислотному составу находится на удовлетворительном уровне: у шлифованного риса 80% всего белка составляют глютелины оризенины, содержащие 2,6 – 4% лизина. Преобладающие фракции овса – глобулины и глютелины, в которых содержится до 5,5% лизина, что приводит к хорошей сбалансированности овса по этой наиболее дефицитной аминокислоте. Белки гречихи в основном представлены глобулинами и альбуминами, поэтому они наиболее сбалансированы по незаменимым аминокислотам. Важнейшей продовольственной культурой является пшеница, так как благодаря содержащейся в ней клейковине из нее получают хлеб с пористым, упругим и эластичным мякишем. Клейковина – важнейший фактор хлебопекарного достоинства пшеничной муки. От нее зависит газоудерживающая способность теста, а, следовательно, объем и пористость хлеба. Крепкая клейковина в нормальной муке дает слишком тугое тесто с трудом поддающееся растяжению диоксидом углерода. Слабое тесто плохо задерживает диоксид углерода, так как свойственная ему слабая клейковина не может создать в тесте белкового каркаса необходимой прочности. Сильная клейковина при брожении более стойко сохраняет присущие ей физические свойства. Качество клейковины определяется главным образом свойствами, входящих в ее состав клейковинообразующих белков глиадина и глютенина. На долю белков приходится (%) 73 – 90, в среднем 83,5, в том числе клейковинообразующих 74 – 85, в среднем 79,5, остальное – альбумины и глобулины 3,35 – 6,75, в среднем 4. Содержание глиадина во всех случаях преобладает над глютенином. Соотношение между их количеством колеблется от 1,0 (глютенин) до 1,10 – 1,43 (глиадин), в среднем 1 – 1,21. Липиды, главным образом связанные – в среднем свободных 1%, связанных 6%. Небелковые вещества оказывают влияние на изменение ее свойств, наиболее существенно – липиды, взаимодействующие с белками. С помощью ионообменной хроматографии, гельхроматографии, электрофореза и других методов глиадиновая фракция пшеницы разделена на большое число индивидуальных компонентов. Электрофоретические компоненты глиадина условно объединяют в порядке уменьшения электрофоретической подвижности в кислой среде в четыре группы: α-, β-,γ- и ω-глиадины, каждая из которых состоит из нескольких компонентов. Общее число белковых компонентов в пшенице может достигать 40 – 50. При строго определенных условиях электрофореза в ПААГ или крахмальном геле электрофоретический спектр рассматривается как генотипический признак вида и сорта пшеницы. Большинство глиадиновых белков построено из одной полипептидной цепи с молекулярной массой 30 – 45 кД и внутримолекулярными дисульфидными связями (рис. 4.1). В меньшем количестве в состав глиадина входят белки с молекулярной массой 22; 25,6; 48,8; 57,3 кД, а также димеры, построенные из одноцепочных молекул главного типа (36,5 и 44,2 кД). От других компонентов в большей степени отличаются ω-глиадины, имеющие слабый заряд, высокое содержание глутамина, глутаминовой кислоты, пролина, гидрофобных остатков аминокислот и не содержащие цистина и метионина и, соответственно, внутримолекулярных дисульфидных связей.
Глютенин пшеницы является более гетерогенной белковой фракцией по сравнению с глиадином. Он состоит из многих компонентов с молекулярной массой от 50 до 3000 кД и без разрыва дисульфидных связей не способен мигрировать в гель при электрофорезе. Восстановленный глютенин разделяется при электрофоретическом анализе не менее чем на 15 компонентов, состоящих из одной полипептидной цепи с молекулярными массами от 11,6 до 133 кД. Эти данные позволяют утверждать, что Глютенин – это белок, построенный из многих полипептидных цепей, соединенных между собой дисульфидными связями. Расчеты показывают, что на каждую полипептидную цепь глютенина приходится 2 – 3 дисульфидные связи с соседними цепями. Главной трудностью при выяснении особенностей строения глютенина является способность белков к агрегации, которую трудно преодолеть известными в настоящее время методами. До сих пор изучаются значения молекулярных масс компонентов и целого белка этой фракции. Так, по последним данным отечественных ученых, Глютенин состоит из белковых частиц, включающих несколько субъединиц с молекулярной массой всего 100 – 300 кД, тогда как на долю частиц сверхвысокой молекулярной массы и одноцепочных молекул приходится не более 20%. Предложены несколько гипотез строения глютенина и клейковины, однако ни одна из них не дает полного ответа на вопросы взаимосвязи его особенностей с природой вязко-эластичных свойств пшеничного теста. До конца не выяснен вопрос, чем отличаются глютенины зерновых культур, способных и не способных к формированию клейковинного комплекса. Реологические свойства клейковины и теста получают более полное обоснование, если принять линейную структуру глютенина, тогда и вязкость теста из пшеницы, ржи и ячменя можно объяснить сильным раскручиванием достаточно гибких цепей и постоянным перемещением их относительно руг друга. Свойство эластичности возникает вследствие тенденции растянутых, незакрученных полипептидных цепей возвратиться к их прежней конформации. Причиной же отсутствия вязко-эластичных свойств овсяного и кукурузного теста является ветвящийся способ соединения полипептидных цепей, характеризующийся трехмерной разветвленной структурой. Во всем мире интенсивно проводятся исследования, посвященные зависимости хлебопекарных качеств пшеницы от полипептидного состава глютениновой фракции в связи с различиями сортов и классов на генетическом уровне. Установлено, что наиболее выраженное влияние на реологические свойства клейковины и качества хлеба оказывают присутствие высокомолекулярных субъединиц глютенина (100 кД) или соотношение высоко- и низкомолекулярных субъединиц. Всего обнаружено около 25 субъединиц с высокой молекулярной массой, 3 – 5 из них присутствует в каждом сорте. Каждой субъединице присвоен номер в зависимости от подвижности в ПААГ с ДДС-Na, и выясняется конкретная роль ее в обеспечении качества зерна. Реологические свойства клейковины и качество пшеничного хлеба зависят не только от присутствия вусокомолекулярных субъединиц (60%), но и от наличия хромосомы 1BL/1RS (7%), полиморфизма низкомолекулярного глютенина, глиадина (α-, β-, γ-, ω-), количества белка и активности α-амилазы (31%). Глютенин придает клейковине упругие свойства, а глиадин обуславливает растяжимость и связность, то есть ни Глютенин, ни глиадин в отдельности не обладают характерными реологическими свойствами клейковины, только взаимодействие этих фракций в едином комплексе создает клейковинный белок со всеми присущими ему особенностями. Предполагают, что «полипептидные цепи глиадина в разных местах и разными связями соединяются с полимеризованными молекулами глютениновой фракции, объединяя их в сложную трехмерную сетку переплетающихся полипептидных цепей» (А. Вакар,1975). В структуре такой сетки значительную роль помимо ковалентных дисульфидных связей играют нековалентные взаимодействия: водородные, электростатические (ионные) связи и гидрофобное взаимодействие. Всем им отводится важная роль при объяснении различий в реологических свойствах крепкой и слабой клейковины (растяжимости, связности, упругости, эластичности). Аминокислотный состав клейковинного белка и соотношение глиадиновой и глютениновой фракций не являются показателями его качества, тогда как растворимость, содержание водородных, дисульфидных связей и вискозиметрические характеристики соотносятся с различиями реологических характеристик клейковины. Крепкая клейковина отличается от слабой меньшей растворимостью в разных растворителях, большим количеством водородных и дисульфидных связей, меньшими значениями характеристической вязкости (η), удельного гидродинамического объема и осевого отношения частиц (в/а). Частицы крепкой клейковины имеют уплотненную структуру, слабой – разрыхленную. Боле высокая скорость агрегации белков клейковины хорошего качества при действии на них солей свидетельствует о большей роли гидрофобных взаимодействий в структуре крепкой клейковины по сравнению со слабой. Признавая за глиадином и глютенином главенствующую роль в обеспечении качества клейковины, необходимо учитывать роль небелковых соединений в формировании ее структуры. В конце XX столетия в Сибирском институте физиологии и биохимии растений выполнено исследование, выдвинувшее концепцию формирования белкового комплекса клейковины пшеницы, основанной на регуляторной функции ферментов тиол-дисульфидного обмена. Показано, что в развивающихся зерновках функционирует специализированная система ферментов, катализирующая образование дисульфидных связей в белках (тиол: кислородредуктаза), их диссоциацию (тиол: протеин-дисульфидизомераза). В тиол:дисульфидном обмене клейковины принимает участие трипептид глютатион. Взаимопревращение окисленной и восстановленной форм глютатиона катализируется группой ферментов приведенных выше. Глютатион оказывает большое влияние на активность ферментов, особенно тех, действие которых связано с превращениями белков. Окисленный глютатион изображают сокращенно Г–S–S–Г, восстановленный –Г–SH. Свойства белков созревающего и прорастающего зерна связаны с содержанием –S–S– связей и –SH-групп. При хорошем качестве клейковины соотношение Г–S–S–Г/Г–SH высокое. При прорастании зерна дисульфидные связи распадаются с одновременным увеличением сульфгидрильных групп и ослаблением качества клейковины. Разработан способ ферментативного улучшения хлебопекарного качества пшеничной муки. Берут небольшое количество растительного масла и небольшое количество соевой муки, особенно богатой ферментом липоксигеназой, затем энергично размешивают эту смесь и вносят в пшеничное тесто. Липоксигеназа окисляет кислородом воздуха ненасыщенные жирные кислоты. При этом кислород присоединяется к двойным связям жирных кислот, образуя их перекиси (пероксиды), обладающие очень сильным окисляющим действием. Гидроперекиси жирных кислот укрепляют клейковину муки, улучшают ее физические свойства. На качество клейковины большое влияние оказывают вещества, содержащие сульфгидрильные группы, – SH. Эти вещества при добавлении их в небольшом количестве к муке или к тесту резко ухудшают качество клейковины и теста, вызывают их расплывание и разжижение. Среди соединений, содержащих группу –SH, нужно особенно отметить уже рассмотренные ранее аминокислоты цистеин и глютатион. Глютатион представляет особый интерес, так как содержится в большом количестве в зародыше пшеничного зерна (0,45%), а также в дрожжах (особенно старых). Глютатион оказывает на клейковину сильное разжижающее действие – клейковина и тесто расплываются и ослабевают. Отрицательное влияние на клейковину оказывает только восстановленная форма глютатиона (Г – SH). Качество клейковины зависит также от действия протеолитических ферментов. Под их влиянием клейковина теряет свои первоначальные физические свойства, разжижается и иногда становится неотмываемой. Это явление наблюдается у муки, полученной из зерна, пораженного клопами-черепашками. Из такой муки нельзя отмыть клейковину потому, что клопы-черепашки, накалывая созревшее зерно, впускают в него слюну, содержащую активный протеолитический фермент. Внесенный в зерно протеолитический фермент сохраняется в нем, фермент начинает действовать, разрушая белки клейковины в приготовленном из такой муки тесте. В зернах злаковых и семенах бобовых культур содержатся белки-ингибиторы, способные соединяться с протеолитическими ферментами, снижая их активность, что также может сказываться на качестве клейковины.
|