Глава 3. Результаты исследования
3.1 Исследование микробной биодеградации полигидроксибутирата и полигидроксигексаноата в прикорневой зоне лиственницы
Микробиологический анализ показал, что в контрольной почве количество бактерий на момент отбора образцов в июне и ноябре было значительно выше, чем в июле и октябре, что объясняется погодными условиями – лето было аномально жарким и сухим. Однако на поверхности полимерных пленок общая численность гетеротрофных бактерий варьировала незначительно (рисунок 7, приложение В).
Рисунок 7 - Общее количество почвенных бактерий (РПА) По данным литературы полимер является субстратом для микроорганизмов, на нем формируются пленки обрастания, что приводит к увеличению численности микроорганизмов в пленках по сравнению с нативной почвой [3]. В наших исследованиях количество почвенных гетеротрофных бактерий в контрольной почве было выше, чем на поверхности образцов полимеров, или достоверно не отличалась. Однако, количество бактерий-деструкторов, растущих на питательной среде с полимером, к концу эксперимента (ноябрь) было достоверно выше, чем в контрольной почве (рисунок 8).
Рисунок 8 - Общее количество бактерий-деструкторов начальной и конечной точке экспозиции (среда с полимером)
В июне в образцах контрольной почвы и на поверхности полимеров количество бактерий-деструкторов составляло от 1,05 до 4,5×108 КОЕ в 1 г, тогда как в ноябре популяция деструкторов увеличилась на поверхности пленок в 5-20 раз по сравнению с исходной. Это связано с тем, что требуется время для индукции синтеза ферментов, гидролизующих ПГА, и развития микроорганизмов-деструкторов. Из анализируемых групп микроорганизмов были выделены доминирующие бактерии, способные к гидролизу полимера. В результате скрининга было проверено более 33 изолятов бактерий из прикорневой зоны лиственницы и 13 изолятов актиномицетов. Из них 13 изолятов бактерий и 3 изолята актиномицетов, обладали гидролитической активностью по отношению к полимеру (образование прозрачных зон). Видовое разнообразие существенно различалось: количество штаммов-деструкторов в почве с полимером значительно превышало количество штаммов-деструкторов в контрольной почве. В целом, по совокупности культуральных, морфологических и физиолого-биохимических признаков бактерии-биодеструкторы были отнесены к следующим родам: Nocardioides, Bacillus, Micrococcus, Acinetobacter, Rhizobium, Pseudomonas. Изучение таксономического состава микрофлоры контрольных образцов почвы показало, что среди бактерий-деструкторов преобладали грамположительные спорообразующие бактерии рода Bacillus, составляющие около 60% идентифицированных видов. Кроме того, были выделены грамотрицательные бактерии Acinetobacter (20%) и Rhizobium (20%) (рисунок 9).
Рисунок 9 - Процентное соотношение бактерий-деструкторов в контрольной почве
В составе микробоценоза, сформировавшегося вокруг полимерных пленок в условиях прикорневой зоны лиственницы, также преобладали представители рода Bacillus (54,5%), на втором месте по численности – Nocardioides (27,3%). В небольшом количестве были представлены следующие бактерии: Micrococcus, Pseudomonas (9.1%) (рисунок 10).
Рисунок 10 - Процентное соотношение бактерий-деструкторов вокруг полимерных пленок
Род Nocardioides. Представители рода образуют плеоморфные элементы и разветвленный вегетативный мицелий. Вегетативный мицелий представлен обильно ветвящимися гифами, растущими на поверхности и проникающими внутрь агаризованной среды; гифы распадаются на фрагменты, которые могут быть неправильной, палочковидной или кокковидной формы. Воздушный мицелий, если образуется, состоит из неправильных, редко и неправильно ветвящихся или неразветвленных гиф, которые распадаются на палочковидные фрагменты, от коротких до удлиненных. Фрагменты как первичного, так и воздушного мицелия дают новый мицелий. Встречаются штаммы с подвижными и штаммы с неподвижными клетками. Обнаружены по всему земному шару в почвах, а также в травяном покрове (рисунок 11).
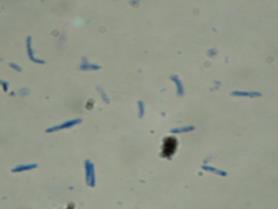
Рисунок 11 - Морфология бактерий рода Nocardioides Род Bacillus. Этот род представлен грамположительными прямыми палочками, 0,5-2,5×1,2-10 мкм, с закругленными концами, часто в парах или цепочках. Подвижные за счет перитрихальных жгутиков. Эндоспоры овальные, высокоустойчивые ко многим неблагоприятным воздействиям и образуется не боле одной споры в клетке. Аэробы и факультативные анаэробы, хемоорганотрофы. Обычно каталазоположительные. Обнаружены в разнообразных местообитаниях, некоторые виды патогенны для позвоночных (рисунок 12).
Рисунок 12 – Морфология бактерий рода Bacillus Род Micrococcus. Представители рода грамположительные клетки сферической формы 0,5-2 мкм, в парах или тетрадах, но не в цепочках. Редко подвижные, неспорообразующие. Облигатные аэробы, хемоорганотрофы. Колонии обычно желтые или красные, растут на простых средах. Каталазоположительные и мало оксидазоположительные. Встречаются на коже млекопитающих и в почве, однако выделены в основном из пещевых продуктов и из воздуха (рисунок 13).
Рисунок 13 – Морфология бактерий рода Micrococcus Род Acinetobacter. Бактерии рода грамотрицательные палочки диаметром 0,9-1,6 мкм и длинной 1,5-2,5 мкм в стационарной фазе роста становятся сферическими. Обычно в парах и цепочках, спор не образуют. Движение рывками, предположительно обусловленное наличием полярных фимбрий. Аэробы. Оксидазоотрицательные и каталазоположительные. Встречаются в почве, воде и сточных водах (рисунок 14).
Рисунок 14 – Морфология бактерий рода Acinetobacter Род Rhizobium. Род представлен грамотрицательными палочками, 0,5-0,9×1,2-3,0 мкм. Для неблагоприятных для роста условиях обычно плеоморфные, содержащие гранулы поли-β-гидроксибутирата. Подвижные за счет единственного полярного или субполярного жгутика либо перитрихальных жгутиков. Аэробы и хемоорганотрофы. Колонии округлые, выпуклые, полупрозрачные, приподнятые, слизистые. Характерная особенность этих организмов – способность проникать в корневые волоски бобовых тропического пояса и вызывать образование корневых клубеньков, в которых бактерии присутствуют как симбионты (рисунок 15).
Рисунок 15 – Морфология бактерий рода Rhizobium Род Pseudomonas. Представлен грамотрицательными прямыми или слегка изогнутыми палочками, 0,5-1,0×1,5-5,0 мкм. У многих видов накапливается в качестве запасного источника углерода поли-β-гидроксибутират, который виден как включения после окраски суданом. Подвижны за счет одного или нескольких полярных жгутиков; в отдельных случаях неподвижны. Аэробы, хемоорганотрофы. Большинство видов в органических факторах роста не нуждается. Оксидазоположительные или –отрицательные и каталазоположительные. Широко распространены в природе. Некоторые виды патогенны для человека, животных и растений (рисунок 16).
Рисунок 16 – Морфология бактерий рода Pseudomonas
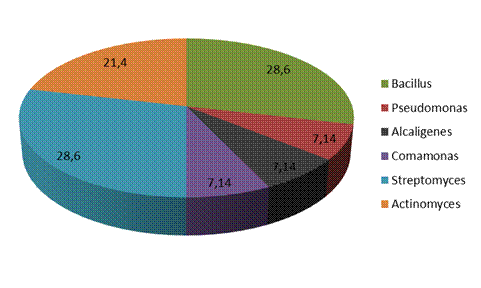
Как показали комплексные исследования, проводимые сотрудниками Института биофизики СО РАН, разрушение полимеров обоих типов в почве под лиственницей в 2013 г. происходило очень медленно из-за недостатка влаги в почве (Приложение Б). 3.2 Исследование микробной биодеградации полигидроксибутирата и полигидроксивалерата в пресной воде Из анализируемых групп микроорганизмов были выделены доминирующие бактерии, способные к гидролизу полимера. Из пленочных образцов было выделено в чистые культуры 15 изолятов бактерий и актиномицетов, обладающих гидролитической активностью в отношении полимера. На основании сходных морфотипов были отобраны 14 штаммов, способных к биодеструкции ПГА, из них 7 штаммов бактерий и 7 штаммов актиномицетов, которые в последующем были идентифицированы по совокупности морфологических, культуральных, биохимических и молекулярно-генетических признаков (Приложение А). Изучение микробиоценоза образцов пресной воды показало, что среди микроорганизмов-деструкторов преобладали грамположительные бактерии: спорообразующие бактерии рода Bacillus, составляющие около 28,6% идентифицированных видов, а также были выделены актиномицеты из родов Streptomyces (28,6%) и Actinomyces (21,4%). Кроме того, были выделены грамотрицательные бактерии Pseudomonas sp (7,14%), Alcaligenes sp (7,14%) и Comamonas sp (7,14%) (рисунок 17).
Рисунок 17 – Процентное соотношение бактерий-деструкторов
Культуры штаммов БП/2, Б-17, Б-17(б) и Б-19 на агаризованной среде формировали гладкие матовые колонии. Отличались способностью к образованию эндоспор. В нативных препаратах были представлены прямые палочки, подвижные. Грамположительные. Бактерии штаммов БП/2, Б-17, Б-17(б) и Б-19 проявляли сходство и по другим признакам: каталазо- и оксидазоположительные, активно продуцировали протеазу. Амилазу не продуцируют. Проявляют липазную и лецитиназную активность. Глюкозу, мальтозу и сахарозу ферментировали с образованием кислоты. По совокупности признаков штаммы БП/2, Б-17, Б-17(б) и Б-19 были отнесены к роду Bacillus (рисунок 18).
Рисунок 18 – Морфология бактерий рода Bacillus Бактерии штамма БП/6 в нативных препаратах представляли собой прямые палочки. Подвижные, грамотрицательные. Неспорообразующие. Каталазоположительные и оксидазоположительные. Обладали амилолитической и протеолитической активностью. Липазную и лецитиназную активность не проявляют. Аэробные микроорганизмы. Ферментировали с образованием кислоты глюкозу и сахарозу. По совокупности признаков бактерии штамма БП/6 были отнесены к роду Pseudomonas sp. (рисунок 19).
Рисунок 19 – Морфология бактерий рода Pseudomonas sp.
На агаризованной среде бактерии штамма ГВ-10б формировали белые, блестящие колонии. Грамотрицательные кокки. Не образуют спор, не подвижны. Каталазоположительные и оксидазоположительные. Обладали амилолитической и липазной активностью. Протеазу и лецитиназу не продуцируют. Аэробы. Кислоту на средах Гисса не образовывают. По совокупности признаков бактерии штамма ГВ-10б были отнесены к роду Alcaligenes sp. (рисунок 20).
Рисунок 20 – Морфология бактерий рода Alcaligenes sp.
Бактерии штамма Б-18 формировали на РПА белые, блестящие колонии. Клетки в мазках были представлены как грамотрицательные, подвижные, бесспоровые палочки. Каталазоположительные и оксидазоположительные. Обладают амилолитической и протеолитической активностью. Липазной и лецитиназной активность не обладают. Лактозу слабо ферментатировали с образованием кислоты; глюкозу, мальтозу, сахарозу и манит, не усваивали. По совокупности признаков штамм Б-18 был отнесен к роду Comamonas sp. (рисунок 21).
Рисунок 21 – Морфология бактерий рода Comamonas sp.
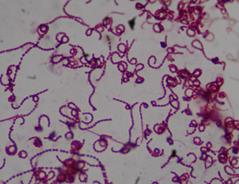
Культуры штаммов БП/2(А), БП/1(А), БП/5(А) и ГВ-9а формировали субстратный и воздушный мицелий и спирально изогнутые спорангии, образующие цепочки спор. Споры неподвижные. Колонии обособленные и лишайникоподобные, маслянистые. Образуют желтый и белый пигменты. Грамположительные. Аэробы. Каталазоположительные. По совокупности признаков штаммы БП/2(А), БП/1(А), БП/5(А) и ГВ-9а были отнесены к роду Streptomyces (рисунок 22).
Рисунок 22 – Морфология актиномицетов рода Streptomyces.
Заключение 1. Определена общая численность почвенных бактерий в прикорневой зоне лиственницы, а также в почве с поверхности полимерных пленок. Показано, что в опытных образцах количество бактерий-деструкторов полигидроксиалканоатов увеличивалось к концу вегетационного периода в 5-20 раз, тогда как в контроле – лишь в 1,4 раза. 2. Из 16 изолятов почвенных бактерий, обладающих гидролитической активностью в отношении ПГА, идентифицированы представители родов Bacillus, Nocardioides, Micrococcus, Acinetobacter, Rhizobium и Pseudomonas. 3. Из 14 изолятов тропических пресноводных бактерий, обладающих гидролитической активностью в отношении ПГА, идентифицированы представители родов Bacillus, Alcaligenes, Comamonas, Streptomyces и Pseudomonas. 4. Среди микроорганизмов деструкторов преобладали представители рода Bacillus, доля которых составляла от 28,6 до 60 % от всех выделенных штаммов.
|