Карбоновые кислоты, их производные
1. Карбоновые кислоты в природе, их использование, связи в карбоксильной группе; индуктивный эффект, гомологический ряд, изомерия, номенклатура, способы получения. Физико-химические и пожароопасные свойства предельных и непредельных одноосновных карбоновых кислот. 2. Особенности водородных связей в карбоновых кислотах (по сравнению со спиртами и оксосоединениями), их влияние на изменение физико-химических и пожароопасных свойств данных веществ. 3. Краткая характеристика карбоновых кислот: муравьиной, уксусной, акриловой, метакриловой, бензойной, стеариновой, олеиновой, линолевой и линоленовой. 4. Двухосновные карбоновые кислоты.
3ЗАДАНИЕ
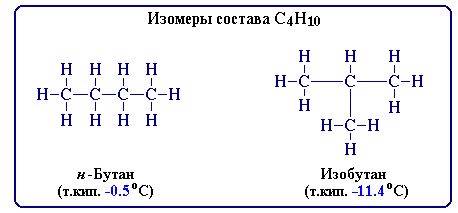
Судя по тому как записана формула, связь должна быть не двойная, а тройная. (1,2,3 формулы с тройной связью) пентин-1CH3-CH2-СH2-C=CH, Изомеры: бутин-2 бутадиен-1,3 CH2=CH-CH=CH2 18 ВАРИАНТ 1 ЗАДАНИЕ последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения). 2. Химическое строение можно устанавливать химическими методами. (В настоящее время используются также современные физические методы). 3. Свойства веществ зависят от их химического строения. 4. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы - предвидеть свойства. 5. Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга. Теория Бутлерова явилась научным фундаментом органической химии и способствовала быстрому ее развитию. Опираясь на положения теории, А.М. Бутлеров дал объяснение явлению изомерии, предсказал существование различных изомеров и впервые получил некоторые из них. Понятие о изомерии Еще до создания теории строения были известны вещества одинакового элементного состава, но c разными свойствами. Такие вещества были названы изомерами, а само это явление - изомерией. В основе изомерии, как показал А.М. Бутлеров, лежит различие в строении молекул, состоящих из одинакового набора атомов. Таким образом, изомерия - это явление существования соединений, имеющих одинаковый качественный и количественный состав, но различное строение и, следовательно, разные свойства. Например, при содержании в молекуле 4-х атомов углерода и 10-ти атомов водорода возможно существование 2-х изомерных соединений:
В зависимости от характера отличий в строении изомеров различают структурную и пространственную изомерию. Структурные изомеры - соединения одинакового качественного и количественного состава, отличающиеся порядком связывания атомов, т.е химическим строением.
Например, составу C5H12 соответствует 3 структурных изомера:
Пространственные изомеры (стереоизомеры) при одинаковом составе и одинаковом химическом строении различаются пространственным расположением атомов в молекуле.
Пространственными изомерами являются оптические и цис-транс изомеры (шарики разного цвета обозначают разные атомы или атомные группы): 2 ЗАДАНИЕ В общем виде уравнение электролитической диссоциации основания имеет вид: NаОН «Na+ + OH-; Ва(ОН)2 «Ba2+ + 2OH-; NH3·H2O «NH4+ + OH-. Гидроксиды металлов типа NаОН и Ва(ОН)2, представляющие собой ионные кристаллы, являются сильными электролитами, а гидрат аммиака (ковалентное соединение) — это слабое основание. Некоторые из щелочей аналогично диссоциируют и при плавлении, например КОН. Большинство же основных гидроксидов разлагаются при нагревании на оксиды и воду еще до плавления. Основания — гидроксиды металлов — могут быть получены при взаимодействии неблагородных металлов с водой или основных оксидов с водой: 2Nа + 2Н2О = 2 NаОН + Н2, СаО + Н2О = Са(ОН)2. Оксиды металлов, которые подобным путем образуют основания, раньше называли основными ангидридами. Типичные свойства оснований по Аррениусу связаны с тем, что они поставляют в водный раствор гидроксид-ионы ОН-. На этом основано обнаружение щелочей с помощью индикаторов. Так, самый распространенный в лаборатории индикатор — лакмус окрашивается растворами щелочей в синий цвет. Кислоты. Кислоты исторически получили такое название из-за кислого вкуса водных растворов таких веществ, как хлороводород или уксусная кислота. С точки зрения теории электролитической диссоциации кислоты — это вещества, диссоциирующие в водном растворе с образованием катионов одного вида — катионов водорода Н+, В общем виде уравнение электролитической диссоциации кислоты имеет вид: Н2SО4 = 2Н+ + SО2- СН3СООН = Н+ + СН3СОО-. Таким образом, характеристической составной частью всех кислот является водород, способный диссоциировать в водный раствор. кислота — это водородсодержащее соединение, водород которого может быть замещен на металл с образованием соли: Мg + Н2SO4 = МgSO4 + Н2
Следует различать кислородсодержащие кислоты и бескислородные кислоты. Все кислоты являются потенциальными электролитами в водном растворе. Под воздействием полярных молекул воды они отщепляют катионы водорода, которые мгновенно гидратируются водой и образуют катионы оксония Н3О+, так как простые катионы водорода Н+, являющиеся по существу индивидуальными протонами р+, не способны к существованию в водном растворе. Среди кислот есть как сильные электролиты (Н2SО4, НМО3, НС1), так и слабые (Н2СO3, Н2S). Кислородсодержащие кислоты могут быть получены взаимодействием кислотных оксидов с водой: СО2 + Н2О = Н3СО3; SО3 + Н2О = Н2SО4. Ранее такие оксиды неметаллов называли кислотными ангидридами. Многим неметаллам, ввиду многообразия их степеней окисления, отвечает несколько кислородсодержащих кислот. Для хлора известны: НСlO4 — хлорная кислота, НСlO2 — хлористая кислота, НС1О3 — хлорноватая кислота, НСlO — хлорноватистая кислота. Металлы, которые проявляют несколько степеней окисления, также могут образовывать кислотные оксиды и кислоты. Многоосновные кислоты, содержащие в молекулах по два или несколько атомов водорода, способных замещаться на атомы металла, обычно являются слабыми электролитами и диссоциируют ступенчато, причем каждая следующая стадия протекает в значительно меньшей степени, чем предыдущая: Н3PO4 «н+ + н2РО4- н2ро4-«н+ + нРО42- нРО42-«н+ + РО43- Типичные свойства кислот по Аррениусу связаны с тем, что они поставляют в водный раствор катионы водорода Н+(Н3О+). На этом основано обнаружение кислот с помощью индикаторов. Так, самый распространенный в лаборатории индикатор — лакмус окрашивается растворами кислот в красный цвет. Соли. С точки зрения теории электролитической диссоциации соли — это вещества, которые в водном растворе диссоциируют с образованием катионов основания и анионов кислотного остатка: BaС12 = Ba2+ + 2С1. 3 ЗАДАНИЕ C5H12-пентан СН3- СН2- СН2- СН2- СН3 СН3-СН-СН2-СН3 2метилбутан(изомер СН3-СН2-СН2-СН2-СН2-СН3 гексан(изомер) 19 БИЛЕТ 1 ЗАДАНИЕ Химического строения- это теория! теория которая описывает строение органических соединений, порядок расположения атомов и связей в молекуле, взаимное влияние атомовю. Ещё и связь строения с физ. и хим. свойствами веществ Химического строения - теория которая описывает строение органических соединений, порядок расположения атомов и связей в молекуле, взаимное влияние атомовю. 2 ЗАДАНИЕ
|