КЛАССИФИКАЦИЯ. Аминокислоты классифицируют по структурным признакам.
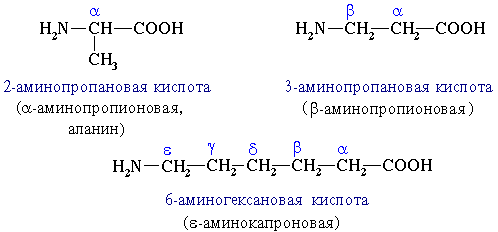
Аминокислоты классифицируют по структурным признакам. 1. В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α-, β-, γ-, δ-, ε- и т. д.
2. В зависимости от количества функциональных групп различают кислые, нейтральные и основные. 3. По характеру углеводородного радикала различают алифатические (жирные), ароматические, серосодержащие и гетероциклические аминокислоты. Приведенные выше аминокислоты относятся к жирному ряду. Примером ароматической аминокислоты может служить пара-аминобензойная кислота:
Примером гетероциклической аминокислоты может служить триптофан – незаменимая α- аминокислота 3 ЗАДАНИЕ НЕТ ОТВЕТА 23 БИЛЕТ 1 ЗАДАНИЕ ервичной структурой белка называется полная последовательность аминокислотных остатков в полипептидной цепи. Она определяется генотипом, т.е. генами организма. В первичной структуре все связи между аминокислотными остатками являются ковалентными и, следовательно, прочными. Разные белки отличаются друг от друга по первичной структуре: кератин имеет одну последовательность аминокислот, пепсин – другую, соматотропин (гормон роста) – третью и т.д. В первичной структуре белка можно различить N-конец цепочки, содержащий свободную NH2-группу, и С-конец, содержащий свободную СООН-группу. Первым белком, у которого была выявлена аминокислотная последовательность, стал гормон инсулин. Исследования проводились в Кембриджском университете Ф.Сэнгером в 1944–1954 гг. Было выявлено, что молекула инсулина состоит из двух полипептидных цепей (из 21 и 30 аминокислотных остатков), удерживаемых друг около друга дисульфидными мостиками. Однако молекула белка в виде цепи аминокислот, последовательно соединенных пептидными связями, еще не способна выполнять специфические функции. Для этого необходим более высокий уровень структурной организации, выражающийся в усложнении пространственного расположения мономеров. Вторичная структура белка представлена спиралью, в которую закручивается полипептидная цепь. Группы N–H и С=О, входящие в пептидную связь, заметно поляризованы: азот обладает большей электроотрицательностью, чем водород, а кислород – большей, чем углерод.
Кислород группы С=О может образовывать водородные связи с водородом группы N–H (разумеется, расположенной в другой пептидной связи). Одной из разновидностей вторичной структуры является Любопытно, что эта сложная красивая структура сперва была предсказана известным биохимиком Л.Полингом теоретически и лишь потом обнаружена экспериментально. Альтернативная вторичная структура Третичная структура белка представляет собой сложную трехмерную пространственную упаковку 1) ионные, возникающие за счет электростатического взаимодействия между отрицательно и положительно заряженными боковыми группами; 2) гидрофобные («не любящие воду»), устанавливающиеся за счет стремления неполярных радикалов объединяться друг с другом, а не смешиваться с окружающей их водной средой; 3) дисульфидные, которые образуются между атомами серы SH-групп двух остатков аминокислоты цистеина. Эти S–S связи по своей природе являются ковалентными; 4) водородные, которые также возникают за счет взаимодействия между атомами радикалов. Третичная структура белка не является конечной. Для некоторых белков, чаще всего регуляторных, характерна четвертичная структура, необходимая им для эффективного выполнения функции. Четвертичная структура представлена ассоциантом, состоящим из нескольких полипептидных цепей. Например, сложная молекула гемоглобина состоит из двух Пространственная конфигурация белка т.е. третичная и четвертичная структуры называется конформацией. Конформация белка определяется его первичной структурой: белковая цепочка с определенной последовательностью аминокислот самопроизвольно укладывается с образованием природной пространственной конфигурации. Это получило название «самосборка белковой молекулы». Если полипептидную цепь взять за концы, растянуть ее и затем отпустить, то она всякий раз будет свертываться в одну и ту же структуру, характерную для этого вида полипептида. В то же время из сказанного, очевидно, следует, что, изменив всего лишь одну аминокислоту в каком-либо полипептиде, мы получим молекулу с совершенно иной структурой, а значит и с иными свойствами. 2 ЗАДАНИЕ Металлы – это элементы, между атомами которых осуществляется металлическая связь. Это сильно нелокализованная связь, когда свободные электроны (электронный газ) связывают положительные ионы металла, находящиеся в узлах кристаллической решетки. Для осуществления металлической связи необходимо, чтобы атомы имели свободные орбитали на валентном уровне. Металлическая связь не насыщена и не направлена: она объединяет очень большое число атомов, и при дальнейшем их увеличении делокализация электронов усиливается. Перекрывание s-орбиталей зависит только от расстояния между ними и не зависит от направлений, по которым они сближаются. Металлам присущи характерные признаки, проявляющиеся, как правило, одновременно: 1. Твердость – сопротивление к царапанью, вдавливанию. 2. Пластичность – способность необратимо деформироваться под действием механических нагрузок. 3. Блеск – способность компактного куска металла отражать свет. 4. Большая электро- и теплопроводность. Все эти физические свойства можно объяснить наличием электронного газа в компактном куске металла. 5. Тугоплавкость – если Тпл>1359 0C – тугоплавкие (Ti, Zr, V, Cr, Mo, W) – это связано с прочностью кристаллических решеток этих металлов. Главным признаком металлов как химических веществ является их способность терять электроны при взаимодействии с другими атомами, проявляя восстановительные свойства. В соответствии с восстановительной способностью получен ряд химической активности металлов: от Li до Al – активные, от Al до H+ – средней активности. Металлы, расположенные в ряду активности справа от водорода, называют малоактивными, или благородными. 1. Металлы реагируют с простыми веществами - неметаллами: со фтором – почти все металлы, продукты реакции называют фториды; хлором – почти все, продукты реакции называют хлориды; кислородом – многие металлы, продукты реакции называют оксиды; серой – многие при нагревании, продукты называют сульфидами; водородом, азотом – щелочные и щелочно - земельные металлы, продукты реакции гидриды и нитриды соответственно. 3 ЗАДАНИЕ НЕТ ОТВЕТА 24 билет 1 задание
\ 2задание Рассмотрим эту закономерность на примере третьего периода. У атомов всех элементов три энергетических уровня, на внешнем энергетическом уровне идет увеличение числа электронов, вследствие этого уменьшается радиус атома, увеличивается энергия ионизации и энергия сродства к электрону, - и как результат этого, - увеличивается значение электроотрицательности. В связи с этим, металлические свойства в периоде ослабевают, а неметаллические усиливаются, кислотные свойства оксидов и гидроксидов тоже усиливаются, а оснОвные ослабевают. 3 задание Нет ответа 25 билет 1 задание Рассмотрим эту закономерность на примере третьего периода. У атомов всех элементов три энергетических уровня, на внешнем энергетическом уровне идет увеличение числа электронов, вследствие этого уменьшается радиус атома, увеличивается энергия ионизации и энергия сродства к электрону, - и как результат этого, - увеличивается значение электроотрицательности. В связи с этим, металлические свойства в периоде ослабевают, а неметаллические усиливаются, кислотные свойства оксидов и гидроксидов тоже усиливаются, а оснОвные ослабевают. 2задание Применение углеводородов: 1) благодаря высокой химической активности углеводороды ряда этилена являются ценным сырьем для синтеза многих органических веществ; 2) этиленовые углеводороды не используются в качестве горючего; 3) особенно широко этилен используется для получения органических веществ; 4) этилен применяется для получения этилового спирта, полиэтилена. Он ускоряет созревание плодов (помидоров, цитрусовых и др.) при введении небольших количеств его в воздух теплиц. Этилен и его гомологи используются как химическое сырье для синтеза многих органических веществ; 5) при взаимодействии этилена с хлором получается 1,2-дихлорэтан. Получение углеводородов: 1) углеводороды ряда этилена химически активны; 2) в промышленности эти углеводороды получаются: а) при переработке нефтепродуктов путем высокотемпературного разложения; б) путем дегидрирования предельных углеводородов. Дегидрирование – это отщепление водорода от предельных углеводородов. Например: а) этан → этилен; б) изобутан → изобутилен. Приставка де– означает отделение чего-либо. Реакция дегидрирования обратима; 3) в лаборатории непредельные углеводороды получаются различными способами, например этилен получается из этилового спирта путем отщепления воды при нагревании с серной кислотой. 3 заданине
|



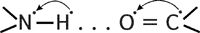
 - спираль, где каждый атом кислорода связан с атомом водорода четвертой по ходу спирали NH-группы.
- спираль, где каждый атом кислорода связан с атомом водорода четвертой по ходу спирали NH-группы. -слой (или складчатый слой) имеет водородную связь между звеньями соседних полипептидных цепей.
-слой (или складчатый слой) имеет водородную связь между звеньями соседних полипептидных цепей.


