Степень окисления элементов
Во многих химических реакциях происходит перемещение электронов от одних частиц к другим. Такие реакции называют окислительно-восстановительными (ОВР). Для характеристики состояния элементов в соединениях введено понятие степени окисления. Число электронов, смещенных от атома данного элемента или к атому данного элемента, называют степенью окисления (С.О.). Поэтому все реакции, наблюдаемые в природе, делят на 2 группы: а) протекающие без изменения С.О.: (реакции обмена, нейтрализации) б) протекающие с изменением С.О.. Такие реакции называют окислительно-восстановительными. Мысленно её можно разделить на две полуреакции: Процесс отдачи электронов: 2Na0 - 2e‾ = 2Na+ - называется окислением Процесс принятия электронов: Cl2 + 2e‾ = 2Cl‾ - называется восстановлением. Частицы, отдающие электроны, называются восстановители, они окисляются. Частицы, принимающие электроны, называются окислителями, они восстанавливаются. В химических окислительно-восстановительных реакциях окисление и восстановление взаимосвязаны. Степень окисления можно рассматривать как условный заряд атома в соединении, вычисленный исходя из предположения, что соединение состоит из ионов. Степень окисления может быть положительная, отрицательная и нулевая. Определение степени окисления проводят, используя следующие правила: 1. Степень окисления кислорода в соединениях равна (-2). Исключение составляют: пероксиды - 2. Степень окисления водорода в соединениях равна (+1), кроме гидридов металлов - LiH, CaH2 и т.п., где степень окисления равна (-1). 3. Степень окисления атомов в простых веществах, например, в металле или в Н2, О2 равна 0. 4. Степень окисления щелочных металлов в соединениях равна (+1). 5. Алгебраическая сумма степеней окисления всех атомов, входящих в состав нейтральной молекулы равна 0, в сложном ионе – заряду иона. Примеры: В зависимости от С.О. атомы могут проявлять различные функции в ОВР. По этому признаку их можно разделить на три группы: 1. Только восстановительные свойства могут проявлять металлы в свободном состоянии, а также атомы в низких С.О.: Cl‾; Br‾; I‾;S‾2; N‾3. Низшая отрицательная степень окисления для неметаллов равна номеру группы минус 8. 2. Только окислительные свойства проявляют атомы с высшей степенью окисления. Она равна номеру группы: 3. Окислительно-восстановительную двойственность проявляют атомы, имеющие промежуточную степень окисления. Пример: атом серы S0 может принимать два электрона и превращаться в ион S‾2, а также может отдать шесть электронов, приобретая заряд S+6. Т.е. в О.В.Р. сера может проявлять свойства окислителя и восстановителя.
3 ЗАДАНИЕ H-COOH - муравьиная кислота 20 БИЛЕТ 1 ЗАДАНИЕ Изомерия — это довольно важная характеристика химических веществ, так как от строения и ориентации молекулы зависят ее свойства. 2 ЗАДАНИЕ НЕТ ОТВЕТА 3 ЗАДАНИЕ Чистое железо малопригодно для изготовления инструментов, деталей машин и т.д., потому что оно слишком мягкое. Основные сплавы железа – чугун и сталь. В них основной компонент, помимо железа – углерод. 21ВАРИАНТ 1 БИЛЕТ
|


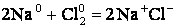
 фторид кислорода
фторид кислорода  .
. (+1) + x + 4(-2) = 0 х = +7
(+1) + x + 4(-2) = 0 х = +7 (+1) + x + 3(-2) = 0 x = +5
(+1) + x + 3(-2) = 0 x = +5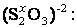 2 x + 3(-2) = (-2) х = +2
2 x + 3(-2) = (-2) х = +2 .
.


