Решение. 1.Определяем молярную массу и молярную массу эквивалента AlCl3
1.Определяем молярную массу и молярную массу эквивалента AlCl3 М(AlCl3) = 133,34 г/моль, Э(AlCl3) = 2.Находим массу AlCl3, необходимую для приготовления 2 л его раствора с массовой долей 12 %. Массовая доля Масса раствора равна произведению объема раствора (V) на его плотность ( М = 2*10-3*1090 кг/м3 = 2,18 кг. В 100 кг раствора содержится 12 кг AlCl3 В 2,18 кг раствора содержится х кг AlCl3
3.Находим молярную концентрацию раствора. Молярная концентрация раствора СМ показывает количество растворенного вещества, содержащего в 1 л раствора. В 2 л раствора содержится 261,6 г AlCl3. В 1 л раствора содержится х г AlCl3,
Молярная концентрация равна 4.Находим молярную концентрацию эквивалента. Молярная концентрация эквивалента (нормальная концентрация) раствора показывает число молярных масс эквивалентов растворенного вещества, содержащихся в 1 л раствора.
5.Нахолим молярность раствора. Молярность раствора Сm (моль/кг) показывает количество растворенного вещества, находящееся в 1 кг растворителя. Масса воды равна 2180 г – 261,6 г = 1918,4 г. Количество AlCl3 равно В 1918,4 г H2O растворено 1,96 моль AlCl3. В 1000 г H2O растворено х моль AlCl3,
6.Находим титр раствора. Титр раствора Т показывает массу (г) растворенного вещества, содержащегося в 1 мл раствора. В 1 л раствора содержится 130,8 г AlCl3.
Пример 2. Напишите уравнение электролитической диссоциации муравьиной кислоты и найдите концентрации ионов Н+ и НСОО- в моль /л в растворе, молярность которого равна 0,01, если константа диссоциации К дисс = 1,8*10-4
|


 44,45 г/моль.
44,45 г/моль. показывает, сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора.
показывает, сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора.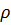 ).
).

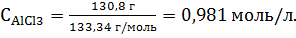
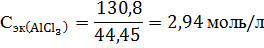


 .
.


