Решение. При смещении равных объемов раствора объем стал в 2 раза больше, а концентрация каждого из растворенных веществ уменьшилась вдвое
При смещении равных объемов раствора объем стал в 2 раза больше, а концентрация каждого из растворенных веществ уменьшилась вдвое, то есть
Концентрации ионов Са2+, NO3-, K+ и SO42- соответственно равны
Ионная сила раствора равна I = 1/2 ( Учитывая коэффиценты активности для
Пример 6. Свойства растворов неэлектролитов и законы Рауля. 1. Осмотическое давление растворов π определяют согласно закону Ванг-Гоффа
где V – объем раствора, м3
Зная π, можно определить молярную массу неэлектролита (М)
где – m – масса растворенного вещества. 2. Давление пара над раствором нелетучего вещества в растворителе (р) ниже давления пара над чистым растворителем (р0) при той же температуре. Согласно закону Рауля
Зная относительное понижение давления пара растворителя над раствором, можно вычислить молярную массу неэлектролита
где -
3. Вычисление молекулярной массы неэлектролита по понижению температуры замерзания или по повышению температуры кипения растворов неэлектролитов.
По закону Рауля
где -
|

 ;
;  .
. ;
;  ;
; 

 .
.
 и
и  (табл.П 6), рассчитываем активности этих ионов в растворе
(табл.П 6), рассчитываем активности этих ионов в растворе ;
; значит осадок не образуется.
значит осадок не образуется.
 количество растворенного вещества, моль;
количество растворенного вещества, моль; - молярная газовая постоянная, равная 8,3144 Дж/моль*К.
- молярная газовая постоянная, равная 8,3144 Дж/моль*К.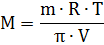


 число молей и массы растворителя и неэлетролита, соответственно;
число молей и массы растворителя и неэлетролита, соответственно; - молярные массы растворителя и неэлектролита.
- молярные массы растворителя и неэлектролита.
 ;
;  ,
, – понижение температуры замерзания и повышение температуры кипения раствора соответственно;
– понижение температуры замерзания и повышение температуры кипения раствора соответственно; скопическая константа растворителя;
скопическая константа растворителя; - эбуллиоскопическая константа растворителя;
- эбуллиоскопическая константа растворителя;  вещества;
вещества; масса растворителя;
масса растворителя;  – молярная масса растворенного вещества.
– молярная масса растворенного вещества. ;
;  .
.


