Основы электрохимии.
Примеры решения типовых задач Пример 1. Для данного окислительно – восстановительного процесса: а)составьте реакции окисления и восстановления; б)укажите окислитель и восстановитель; в)составьте сокращенное ионное и полное молекулярное уравнения ионно – электронным методом; г)покажите переход электронов. Дана схема окислительно-восстановительного процесса K2MnO4 + K2SO4 + H2O KMnO4 + K2SO3 + KOH Решение. По приведенной схеме делаем вывод, что процесс протекает в щелочной среде (присутствует КОН, рН >7). Находим степени окисления всех элементов данной схемы:
Составляем возможные уравнения реакций окисления и восстановления, находим значения их стандартных электродных потенциалов:
Составляем сокращенное ионное уравнение процесса и показываем переход электоронов: S+4O32- + 2Mn+7O4- +2OH- = S+6O42- + 2Mn+6O42- + H2O.
2 е Переходим к полному молекулярному уравнению, показываем переход электронов:
2KMn+7O4 + K2S+4O3 + 2KOH = 2K2Mn+6O4 + K2S+6O4 + H2O
2e Пример 2. Составьте схему работы гальванического элемента, образованного двумя данными металлами, погруженными в растворы солей с известными активностями ионов, рассчитайте ЭДС этого элемента и Дано: Zn; Pb; растворы ZnSO4 и Pb(NO3)2;
|



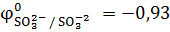
 +e =
+e = 

 .
.


