Горение пропана в кислороде
1. Записываем реакцию горения: С3Н8 + О2 = СО2 + Н2О 2. В молекуле пропана 3 атома углерода, из них образуется 3 молекулы углекислого газа. С3Н8 + О2 = 3СО2 + Н2О 3. Атомов водорода в молекуле пропана 8, из них образуется 4 молекулы воды: С3Н8 + О2 = 3СО2 + 4Н2О 4. Подсчитаем число атомов кислорода в правой части уравнения 2×3 + 4 = 10 5. В левой части уравнения так же должно быть 10 атомов кислорода. Молекула кислорода состоит из двух атомов, следовательно, перед кислородом нужно поставить коэффициент 5. С3Н8 + 5О2 = 3СО2 + 4Н2О Коэффициенты, стоящие в уравнении реакции, называются стехиометрическими коэффициентами и показывают, сколько молей (киломолей) веществ участвовало в реакции или образовалось в результате реакции. Стехиометрический коэффициент, показывающий число молей кислорода, необходимое для полного сгорания вещества, обозначается буквой b. В первой реакции b = 5.
Горение глицерина в кислороде
1. Записываем уравнение реакции горения. С3Н8О3 + О2 = СО2 + Н2О 2. Уравниваем углерод и водород: С3Н8О3 + О2 = 3СО2 + 4Н2О. 3. В правой части уравнения 10 атомов кислорода. В составе горючего вещества есть 3 атома кислорода, следовательно, из кислорода в продукты горения перешли 10 – 3 = 7 атомов кислорода. Таким образом, перед кислородом необходимо поставить коэффициент 7: 2 = 3,5 С3Н8О3 +3,5О2 = 3СО2 + 4Н2О. В этой реакции b = 3,5.
Чаще всего в условиях пожара горение протекает не в среде чистого кислорода, а в воздухе. Воздух состоит из азота (78 %), кислорода (21 %), окислов азота, углекислого газа, инертных и других газов (1 %). Для проведения расчетов принимают, что в воздухе содержится 79 % азота и 21 % кислорода. Таким образом, на один объем кислорода приходится 3,76 объемов азота (79:21 = 3,76). В соответствии с законом Авогадро и соотношение молей этих газов будет 1: 3,76. Таким образом, можно записать, что молекулярный состав воздуха (О2 + 3,76N2). Составление реакций горения веществ в воздухе аналогично составлению реакций горения в кислороде. Особенность состоит только в том, что азот воздуха при температуре горения ниже 20000С в реакцию горения не вступает и выделяется из зоны горения вместе с продуктами горения. Горение водорода в воздухе Н2 + 0,5(О2 + 3,76N2) = Н2О + 0,5×3,76N2 b = 0,5. Обратите внимание, что стехиометрический коэффициент перед кислородом 0,5 необходимо поставить и в правой части уравнения перед азотом.
Горение пропанола в воздухе С3Н7ОН + 4,5(О2 + 3,76N2) =3СО2 + 4Н2О +4,5×3,76N2 b = 4,5. В составе горючего есть кислород, поэтому расчет коэффициента b проводят следующим образом: 10 – 1 = 9; 9: 2 = 4,5.
Теоретический объем воздуха, необходимый для горения рассчитывается по уравнению реакции горения.
1. Записываем уравнение реакции горения
1 кг х м3 С2Н5ОС2Н5 + 6(О2 + 3,76N2) =4СО2 + 5Н2О +6×3,76N2 М = 74 кг 6×4,76 × Vм = =6×4,76×19,35 м3
2. Записываем в уравнении известные и неизвестные величины с указанием размерности. 3. Молярная масса диэтилового эфира 74 кг/кмоль. Записываем эту величину под формулой эфира. 4. При нормальных условиях молярный объем (Vм) любого газообразного вещества составляет 22, 4 л/моль или 22,4 м3/кмоль. Если условия отличаются от нормальных, то необходимо определить, какой объем будет занимать 1 кмоль любого газообразного вещества при данных условиях. Расчет VМ ведут по формуле объединенного газового закона:
Р и Т – данные в задаче температура и давление.
Рассчитаем, какой объем занимает 1 кмоль воздуха (как и любого другого газообразного вещества) при данных температуре и давлении.
5. По уравнению реакции найдем теоретический объем воздуха, необходимый для полного сгорания эфира: Vвтеор =
В случае индивидуального химического соединения объем и состав продуктов горения рассчитывается по уравнению реакции горения.
1. Записываем уравнение реакции горения
3 кг х1 м3 х2 м3 х3 м3 х4 м3 С6Н6 + 7,5(О2 + 3,76N2) = 6СО2 + 3Н2О + 7,5×3,76N2 М = 78 кг 7,5×4,76 × Vм = 6×Vм = 3×Vм = 7,5×3,76×Vм = =7,5×4,76×23,7 м3 =6×23,7 м3 =3×23,7 м3 =7,5×3,76×23,7 м3
2. Рассчитаем, какой объем занимает 1 кмоль газообразных веществ при заданных температуре и давлении.
3. Теоретический объем продуктов горения (VПГ) определяем по уравнению реакции. VПГ =
4. Иногда возникает необходимость рассчитать объем отдельных компонентов продуктов горения и их процентный состав. В этом случае по уравнению реакции определяем объем СО2, Н2О и N2.
V(СО2) = х2 =
V(Н2О) = х3 =
V(N2) = х4 =
Объемная концентрация каждого компонента смеси рассчитывается следующим образом:
jоб (СО2) = jоб (Н2О) = jоб (N2) = Обратите внимание, что более половины объема всех продуктов горения – это азот воздуха, израсходованного на горение. Если же горение протекает с коэффициентом избытка воздуха a > 1, то избыточный воздух также составляет значительную часть продуктов горения.
Стехиометрической концентрацией называется такая концентрация, когда реагирующие вещества взяты в эквивалентных отношениях, при этом коэффициент избытка воздуха a = 1. Расчет стехиометрической концентрации производится по уравнению реакции горения индивидуального вещества. Общие формулы для вычисления объемной и массовой стехиометрической концентрации следующие:
jстехобъем =
jстехмасс =
1. Уравнение реакции горения пропана.
С3Н8 + 5(О2 + 3,76 N2) = 3СО2 +4Н2О + 5· 3,76 N2 b = 5
jстехобъем =
2. Молярная масса М (С3Н8) = 46 г/моль (кг/кмоль);
Vм = jстехмасс =
Концентрационные пределы распространения пламени (область воспламенения) для газо- и паровоздушных смесей могут быть рассчитаны по следующей формуле
где j Н(В) - нижний (верхний) концентрационный предел распространения пламени (НКПР и ВКПР), %; b - число молекул кислорода (коэффициент перед кислородом в уравнении реакции горения вещества); a и b - константы, имеющие значения, приведенные в таблице 4.
Таблица 4.
Значения коэффициентов “ а ” и “ b ” для расчета концентрационных
|

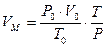 , где
, где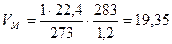 м3/кмоль
м3/кмоль Записываем данную величину под формулой воздуха, умножив ее на стехиометрический коэффициент (6×4,76).
Записываем данную величину под формулой воздуха, умножив ее на стехиометрический коэффициент (6×4,76).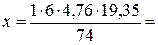 7,5 м3
7,5 м3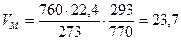 м3/кмоль
м3/кмоль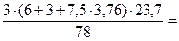 33,9 м3
33,9 м3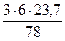 = 5,47 м3
= 5,47 м3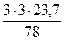 = 2,73 м3
= 2,73 м3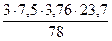 = 25,71 м3
= 25,71 м3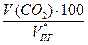 =
= 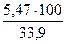 = 16,1 %
= 16,1 %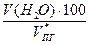 =
= 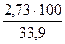 = 8,1 %
= 8,1 %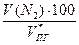 =
= 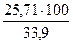 = 75 ,8 %
= 75 ,8 %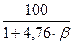 , %
, %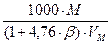 , г/м3.
, г/м3.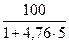 = 4,03 %
= 4,03 %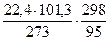 = 26,1 м3/кмоль
= 26,1 м3/кмоль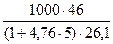 = 71,0 г/м3.
= 71,0 г/м3.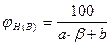 , %,
, %,


