Тема 3. Основные закономерности протекания химических процессов
Задание. Дано уравнение реакции (см. вариант в табл. 3).
1. Для всех веществ, участвующих в реакции, выпишите из приложения 1 значения стандартных термодинамических величин 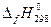 и и 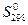 . .
2. Вычислите изменение энтальпии реакции  и определите, является ли данная реакция экзо- или эндотермической. Запишите термохимическое уравнение реакции. и определите, является ли данная реакция экзо- или эндотермической. Запишите термохимическое уравнение реакции.
3. По виду уравнения реакции, не прибегая к расчетам, определите знак изменения энтропии реакции 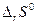 . Вычислив изменение энтропии реакции в стандартных условиях, объясните знак . Вычислив изменение энтропии реакции в стандартных условиях, объясните знак 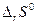 . .
4. Вычислите энергию Гиббса прямой реакции в стандартных условиях 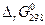 и установите возможность самопроизвольного протекания реакции. и установите возможность самопроизвольного протекания реакции.
5. Определите температуру, при которой реакция находится в равновесии (Тр).
6. Рассчитайте 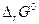 при Т=Тр–100, Т=Тр+100. при Т=Тр–100, Т=Тр+100.
7. Постройте график зависимости 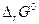 от Т и обозначьте на графике область температур самопроизвольного протекания реакции. от Т и обозначьте на графике область температур самопроизвольного протекания реакции.
8. Вычислите значения константы равновесия Кc для температур: Т=Тр, Т=Тр–100, Т=Тр+100. Cделайте вывод о влиянии температуры на величину Кc и на смещение химического равновесия.
Таблица 3
| № варианта
| 1, 2, 3
| Изменение внешних условий
| | аА + bВ ó cC + dD
| Cо (А),
моль/л
| Cо (В),
моль/л
| С исх
| Р
| V
| Т
| |
| CН4(г) + 2 Н2О(г) ó CO2(г) + 4 Н2(г)
|
|
| ↑
| ↓
| ↓
| ↓
| |
| СS2(г) + 4 Н2(г) ó CH4(г) + 2 Н2S(г)
|
|
| ↑
| ↑
| ↑
| ↓
| |
| SO2(г) + 3 F2(г) ó SF6(г) + О2(г)
|
|
| ↓
| ↓
| ↑
| ↑
| |
| 2 BCl3(г) + 3 Н2(г) ó 2 В(т) + 6 HCl(г)
|
|
| ↑
| ↑
| ↓
| ↓
| |
| 2 AsCl3(г) + 3 Н2(г) ó 2 As(г) + 6 HCl(г)
|
|
| ↑
| ↑
| ↓
| ↓
| |
| 2 Н2S(г) + 3 O2(г) ó2 SO2(г) + 2 Н2О(ж)
|
|
| ↓
| ↓
| ↑
| ↑
| |
| 2 NO(г) + 2 H2S(г) ó N2(г) + 2 H2O(г) + 2S(т)
|
|
| ↑
| ↑
| ↓
| ↓
| |
| СО(г) + 3 Н2(г) ó СН4(г) + Н2О(г)
|
|
| ↓
| ↓
| ↑
| ↑
| |
| 2 NO2(г) + F2(г) ó 2 (NO2)F(г)
|
|
| ↓
| ↓
| ↑
| ↑
| |
| 4 HCl(г) + O2(г) ó 2 Н2О(г) + 2 Сl2(г)
|
|
| ↑
| ↑
| ↓
| ↓
| |
| 2 CО(г) + SО2(г) ó 2 CО2(г) + S(т)
|
|
| ↓
| ↓
| ↑
| ↑
|
Окончание табл. 3
|
| 2 NO(г) + 2 Н2(г) = N2(г) + Н2О(ж)
|
|
| ↑
| ↑
| ↓
| ↓
| |
| 2 NO(г) + 2 SO2(г) ó N2(г) + 2 SO3(г)
|
|
| ↑
| ↑
| ↑
| ↑
| |
| 2 PF3(г) + О2(г) ó 2 POF3(г)
|
|
| ↓
| ↓
| ↑
| ↑
| |
| 2 H2S(г) + SO2(г) ó 3 S(т) + 2 H2O(ж)
|
|
| ↓
| ↓
| ↓
| ↓
| |
| 2 PCl3(г) + O2(г) ó 2 PCl3O(г)
|
|
| ↑
| ↑
| ↑
| ↑
| |
| SiCl4(г) + 2 Н2(г) ó Si(т) + 4 HCl(г)
|
| 0,5
| ↓
| ↓
| ↓
| ↓
| |
| 2 NO(г) + Cl2(г) ó 2 NOCl(г)
|
|
| ↑
| ↑
| ↑
| ↓
| |
| 2 СО(г) + 2 Н2(г) ó СН4(г) + СО2(г)
|
|
| ↓
| ↑
| ↑
| ↓
| |
| CCl4(г) + 2 Н2(г) ó CН4(г) + 2 Cl2(г)
|
|
| ↑
| ↓
| ↑
| ↑
| |
| СO2(г) + 2 NH3(г) ó СО(NH2)2(т) + H2O(г)
|
| 1,5
| ↑
| ↓
| ↓
| ↑
| |
| 2 NO2(г) + O3(г) ó N2O5(г) + O2(г)
|
|
| ↓
| ↑
| ↓
| ↑
| |
| CS2(г) + 2 Сl2(г) = CCl4(г) + 2 S(т)
| 1,5
|
| ↑
| ↓
| ↑
| ↑
| |
| SiH4(г) + 2 O2(г) = 2 H2O(г) + SiO2(т)
|
| 0,5
| ↑
| ↑
| ↓
| ↑
| |
| 2 СН4(г) = С2Н2(г) + 3 H2(г)
|
| –
| ↓
| ↑
| ↑
| ↓
|
П р и л о ж е н и е 1
Термодинамические характеристики некоторых веществ
при 298 К
| Вещество
| D f H °,
кДж/моль
| S°,
Дж/(моль×К)
| D f G°,
кДж/моль
| | As(г)
| 288,71
| 174,1
| 247,42
| | AsCl3(г)
| –270,34
| 328,82
| –258,04
| | В(т)
|
| 5,87
|
| | BCl3(г)
| –402,96
| 290,08
| –387,98
| | ВаО(к)
| –557,9
| 70,29
| –528,4
| | ВаCl2(к)
| –860,1
|
| –810,9
| | ВеО(к)
| –598,7
| 14,1
| –581,6
| | ВеCl2(к)
| –494
|
| –468
| | Br2(г)
| 30,92
| 245,35
| 3,14
| | Сграфит
|
| 5,74
|
| | Салмаз
| 1,83
| 2,38
| 2,85
| | СО(г)
| –110,5
| 197,54
| –137,14
| | СО2(г)
| –393,51
| 213,68
| –394,38
| | СF4(г)
| –933
| 261,4
| –888,37
| | ССl4(г)
| –106,7
| 309,7
| –63,95
| | СН4(г)
| –74,85
| 186,2
| –50,8
| | С2Н2(г)
| 226,75
| 200,82
| 209,21
| | С2Н4(г)
| 52,3
| 219,45
| 68,14
| | С2Н6(г)
| –84,68
| 229,5
| –32,89
| | С6Н6(г)
| 82,93
| 269,2
| 129,68
| | СаО(к)
| –635,5
| 39,7
| –605,2
| | Са(ОН)2(к)
| –986,2
| 83,4
| –898,5
| | СаСО3(к)
| –1207,1
| 92,88
| –1128,76
| | Cl2(г)
|
| 222,96
|
| | ClF(г)
| –49,9
| 217,82
| –51,37
| | CuO(к)
| –165
| 42,64
| –127
| | Cu2О(к)
| –173,2
| 92,93
| –150,5
| | F2(г)
|
| 202,67
|
| | Вещество
| D f H °,
кДж/моль
| S°,
Дж/(моль×К)
| D f G°,
кДж/моль
| | FeO(к)
| –263,8
| 58,8
| –244,3
| | Fe2O3(к)
| –822,16
| 89,96
| –740,98
| | Н2(г)
|
| 130,58
|
| | HBr(г)
| –35,98
| 198,5
| –53,5
| | HCl(г)
| –92,3
|
| –95,27
| | HF(г)
| –268,61
| 173,51
| –270,7
| | HI(г)
| 25,94
| 206,3
| 1,3
| | Н2О(г)
| –241,82
| 188,7
| –228,61
| | Н2О(ж)
| –285,84
| 70,08
| –237,2
| | Н2S(г)
| –20,17
| 205,6
| –33
| | I2(г)
| 62,24
| 260,58
| 19,4
| | N2(г)
|
| 191,5
|
| | NH3(г)
| –46,19
| 192,66
| –16,66
| | NF3(г)
| –131,7
| 260,7
| –84
| | N2F4(г)
| –22
|
|
| | N2O(г)
| 82,01
| 219,83
| 104,12
| | N2O3(г)
| 90,22
| 307,1
| 110,5
|
П р о д о л ж е н и е п р и л. 1
| N2O4(г)
| 11,11
| 304,35
| 99,68
| | N2O5(г)
| 13,3
| 355,65
| 117,14
| | NO(г)
| 90,25
| 210,62
| 86,58
| | NO2(г)
| 34,19
| 240,06
| 52,29
| | NOCl(г)
| 52,59
| 263,5
| 66,37
| | NOF(г)
|
|
| –51
| | NOF3(г)
| –187
| 277,6
| –
| | (NO2)F(г)
| –109
| 259,3
|
| | NH4F(т)
| –463,59
| 71,96
| –348,45
| | СО(NH2)2(т)
| –333,17
| 104,6
| –197,15
| | CS2(г)
| 116,7
| 237,7
| 66,55
| | ССl4(г)
| –106,7
| 309,7
| –63,95
| | Cl2(г)
|
|
|
| | Вещество
| D f H °,
кДж/моль
| S°,
Дж/(моль×К)
| D f G°,
кДж/моль
| | О2(г)
|
| 205,04
|
| | О3(г)
| 142,26
| 238,82
| 162,76
| | РН3(г)
| 5,44
| 210,1
| 13,39
| | Р2О5(к)
| –1492
| 114,5
| –1348,8
| | PCl3(г)
| –287
| 311,7
| –268
| | PCl5(г)
| –366,94
| 364,47
| –297,14
| | PОCl3 (г)
| –558,9
| 323,84
| –512,92
| | F2(г)
|
| 202,67
|
| | PF3(г)
| –956,5
| 272,6
| –935,66
| | PОF3(г)
| –1252,27
| 284,93
| –1203,75
| | S(к)
|
| 31,88
|
| | SO2(г)
| –296,9
| 248,1
| –300,4
| | SO3(г)
| –395,2
| 256,23
| –370,4
| | SO2Cl2(г)
| –363,17
| 311,3
| –318,85
| | SF6(г)
| –1207,08
| 291,62
| –1103,2
| | Si(т)
|
| 18,83
|
| | SiCl4(г)
| –657,52
| 330,95
| –617,6
| | SiН4(г)
| 34,73
| 204,55
| 57,19
| | SiО2(к)
| –903,5
| 46,86
| –850,7
|

Композиция из абстрактных геометрических фигур Данная композиция состоит из линий, штриховки, абстрактных геометрических форм...
|

Важнейшие способы обработки и анализа рядов динамики Не во всех случаях эмпирические данные рядов динамики позволяют определить тенденцию изменения явления во времени...
|

ТЕОРЕТИЧЕСКАЯ МЕХАНИКА Статика является частью теоретической механики, изучающей условия, при которых тело находится под действием заданной системы сил...
|

Теория усилителей. Схема Основная масса современных аналоговых и аналого-цифровых электронных устройств выполняется на специализированных микросхемах...
|
СИНТАКСИЧЕСКАЯ РАБОТА В СИСТЕМЕ РАЗВИТИЯ РЕЧИ УЧАЩИХСЯ В языке различаются уровни — уровень слова (лексический), уровень словосочетания и предложения (синтаксический) и уровень
Словосочетание в этом смысле может рассматриваться как переходное звено от лексического уровня к синтаксическому...
Плейотропное действие генов. Примеры. Плейотропное действие генов - это зависимость нескольких признаков от одного гена, то есть множественное действие одного гена...
Методика обучения письму и письменной речи на иностранном языке в средней школе. Различают письмо и письменную речь.
Письмо – объект овладения графической и орфографической системами иностранного языка для фиксации языкового и речевого материала...
|
Деятельность сестер милосердия общин Красного Креста ярко проявилась в период Тритоны – интервалы, в которых содержится три тона. К тритонам относятся увеличенная кварта (ув.4) и уменьшенная квинта (ум.5). Их можно построить на ступенях натурального и гармонического мажора и минора.
...
Понятие о синдроме нарушения бронхиальной проходимости и его клинические проявления Синдром нарушения бронхиальной проходимости (бронхообструктивный синдром) – это патологическое состояние...
Опухоли яичников в детском и подростковом возрасте Опухоли яичников занимают первое место в структуре опухолей половой системы у девочек и встречаются в возрасте 10 – 16 лет и в период полового созревания...
|
|

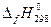 и
и 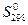 .
. и определите, является ли данная реакция экзо- или эндотермической. Запишите термохимическое уравнение реакции.
и определите, является ли данная реакция экзо- или эндотермической. Запишите термохимическое уравнение реакции.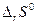 . Вычислив изменение энтропии реакции в стандартных условиях, объясните знак
. Вычислив изменение энтропии реакции в стандартных условиях, объясните знак 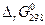 и установите возможность самопроизвольного протекания реакции.
и установите возможность самопроизвольного протекания реакции.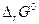 при Т=Тр–100, Т=Тр+100.
при Т=Тр–100, Т=Тр+100.


