Робота 2.2. Дослідження кінетики реакції нейтралізації між твердою кислотою та розчином лугу.
Мета роботи:визначити порядок та природу лімітуючої стадії реакції нейтралізації твердої бензойної кислоти водним розчином КОН, обчислити товщину дифузійного шару. Внаслідок розчинення твердої бензойної кислоти у водному розчині КОН перебігає реакція нейтралізації (2.8). Швидкість цього процесу залежить від швидкості підведення лугу до поверхні поділу твердої та рідкої фаз, тобто від швидкості дифузії. В склянку ємністю 500 см3 кладуть якір магнітної мішалки і наливають мірним циліндром 300 – 400 см3 розчину КОН з концентрацією Скляну паличку з циліндром бензойної кислоти, розміри якого попередньо вимірюють, закріплюють у штативі над поверхнею розчину по центру склянки. Після цього занурюють циліндр у розчин і одночасно вмикають секундомір. Кожні 5 хвилин відбирають піпеткою 10 см3 розчину та титрують його за наявності фенолфталеїну розчином HCl, що має концентрацію 0,05 моль/дм3. Одразу після четвертого відбору проби збільшують швидкість обертів якоря мішалки і виконують ще чотири титрування через такі самі проміжки часу. Для розрахунків константи швидкості реакції нейтралізації за формулою (2.11) необхідно знати або початкову концентрацію розчину KOH ( Константу швидкості гетерогенного процесу нейтралізації
де Оскільки дослід виконується за двох режимів перемішування, то для початкової швидкості перемішування константу швидкості обчислюють за формулою (2.15), а для наступної – за формулою:
де Використовуючи експериментальні ( Звіт 1. Розміри циліндра бензойної кислоти: висота 2. Результати титрування вихідного розчину КОН:
3. Результати кінетичних досліджень: а) побудова графіка залежності б) обчислення за формулами (2.15, 2.16) для табл. 2.2. Таблиця 2.2. Дані для визначенняконстанти швидкості реакції
4. Побудова на основі даних табл. 2.2 на одному графіку залежностей
реакції за різних режимів перемішування:
5. Розрахунок товщини дифузійного шару за різних режимів перемішування:
6. Кінетичні рівняння процесу: 7. Висновок. ЛІТЕРАТУРА: [1, с. 531 – 532; 2, с. 384 – 393; 3, с. 341 – 343; 5, с. 225 – 233; 6, с. 276 – 277, 285 – 287; 7, с. 117; 8, с. 48].
|

 ), або пропорційний цій концентраціїоб’єм HCl (
), або пропорційний цій концентраціїоб’єм HCl ( ), який витрачається на титрування лугу. Для цього вихідний розчин КОН двічі – тричі титрують 0,05 – молярним розчином НСl за наявності фенолфталеїну до зникнення малинового забарвлення, відбираючи 10 см3 проби.
), який витрачається на титрування лугу. Для цього вихідний розчин КОН двічі – тричі титрують 0,05 – молярним розчином НСl за наявності фенолфталеїну до зникнення малинового забарвлення, відбираючи 10 см3 проби. розраховують за формулою:
розраховують за формулою: , (2.15)
, (2.15) – об’єм розчину HCl, який витрачено на титрування відібраної в певний момент часу проби. Дані досліду та обчислень записують у табл. 2.2 (див. звіт).
– об’єм розчину HCl, який витрачено на титрування відібраної в певний момент часу проби. Дані досліду та обчислень записують у табл. 2.2 (див. звіт). , (2.16)
, (2.16) – різниця між часом відбору проб та часом зміни режиму перемішування;
– різниця між часом відбору проб та часом зміни режиму перемішування;  – останній перед зміною швидкості перемішування об’єм HCl, що витратився на титрування реакційної суміші.
– останній перед зміною швидкості перемішування об’єм HCl, що витратився на титрування реакційної суміші.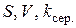 ) та довідникові (
) та довідникові ( ) дані, розраховують товщину дифузійного шару
) дані, розраховують товщину дифузійного шару  (два значення за різних режимів перемішування).
(два значення за різних режимів перемішування).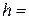 см; діаметр
см; діаметр 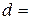 см; площа поверхні
см; площа поверхні 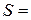 см2.
см2. см3,
см3,  см3,
см3,  см3.
см3. ;
;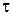 , хв.
, хв.
 , см3
, см3
 ,
, 
 , хв.-1
, хв.-1
 хв.-1
хв.-1 хв.-1
хв.-1 та
та  і визначення за ними констант швидкості
і визначення за ними констант швидкості хв.-1;
хв.-1;  хв.-1
хв.-1 см;
см;  см.
см.


