КІНЕТИКА ГЕТЕРОГЕННИХ ПРОЦЕСІВ
Гетерогенними називаються процеси за участю речовин, що перебувають у різних фазах. До них належать фізичні процеси розчинення газів та твердих речовин у рідинах, будь-які агрегатні перетворення, хімічні реакції згоряння твердого палива, окиснення металів киснем, гетерогенно-каталітичні процеси тощо. Гетерогенні процеси складаються з декількох основних послідовних стадій: перетворення, яке відбувається на поверхні поділу фаз, та у більшості випадків стадій підведення реагентів до цієї поверхні та відведення від неї продуктів (транспортні стадії). Швидкість всього процесу визначається швидкістю найповільнішої стадії, яку називають лімітуючою. Найчастіше саме транспортні стадії є лімітуючими. Вони здійснюються дифузією. Дифузія – це самочинний процес вирівнювання концентрації речовини, рушійною силою якого є градієнт концентрації. Згідно з першимзаконом Фіка елементарна кількість речовини
де
Залежність зміни концентрації речовини від часу в певній точці об’єму фази, де відбувається лінійна (вподовж однієї осі координат) дифузія, описується другим законом Фіка:
Дифузія вважається стаціонарною, якщо концентрація речовини, яка дифундує, в певній точці об’єму фази не залежить від часу, а визначається лише градієнтом концентрації. В цьому випадку в рівнянні (2.2) Швидкість розчинення – це зміна концентрації речовини, що розчиняється, за одиницю часу. Розглянемо фізичний процес розчинення твердої речовини у рідкому розчиннику. Швидкість цього процесу можна виразити через збільшення концентрації розчиненої речовини у розчині за одиницю часу:
де V – об’єм розчину. Якщо в процесі розчинення найповільнішим є відведення молекул розчиненої речовини, що перейшли до розчину, від її твердої поверхні, тобто лімітуючою є дифузійна стадія, то розчин безпосередньо біля поверхні поділу можна вважати насиченим
За будь-якої швидкості перемішування розчину біля поверхні твердого тіла існує нерухомий дифузійний шар, в межах якого перенесення речовини здійснюється тільки дифузією. У дифузійному шарі за умови стаціонарної дифузії концентрація речовини, яка розчиняється, зменшується від
і рівняння (2.1) записати у вигляді:
Тоді для швидкості процесу розчинення згідно з (2.3) та (2.5) маємо:
де Після інтегрування диференціального рівняння (2.6) отримуємо формулу для розрахунку константи швидкості процесу розчинення:
Знаючи константу швидкості досліджуваного процесу, коефіцієнт дифузії речовини у розчині, площу її твердої поверхні, яка контактує з рідиною, та об’єм розчину, можна розрахувати товщину дифузійного шару. Якщо тверду речовину, наприклад, бензойну кислоту, розчиняти у водному розчині лугу, то в системі перебігає хімічний процес нейтралізації: С6Н5СООН (тв.) + КОН (розч.) = С6Н5СООК (розч.) + Н2О. (2.8) Процес є гетерогенним, оскільки реагенти перебувають у різних фазах. Якщо швидкість хімічної стадії процесу (2.8), яка відбувається безпосередньо на поверхні поділу твердої та рідкої фаз, значно вища за швидкість стадії підведення лугу до реакційної поверхні, то концентрація лугу біля поверхні наближається до нуля (рис. 2, б). За умови стаціонарної дифузії вона збільшується в межах дифузійного шару від нуля до об’ємної концентрації
З урахуванням співвідношень (2.1) та (2.9) кінетичне рівняння гетерогенного процесу нейтралізації набуває вигляду:
У формулі (2.10) D – коефіцієнт дифузії лугу в розчині; константа швидкості реакції (2.8), яку розраховують за рівнянням:
де Отже, згідно з рівнянням (2.10), гетерогенна реакція нейтралізації за умови стаціонарної дифузії має перший порядок.
|

 , що переноситься дифузією в напрямку осі х через перпендикулярний цьому напрямку переріз, прямо пропорційна площі перерізу S, градієнту концентрації
, що переноситься дифузією в напрямку осі х через перпендикулярний цьому напрямку переріз, прямо пропорційна площі перерізу S, градієнту концентрації  та часу
та часу 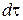 :
: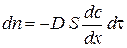 , (2.1)
, (2.1)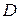 – коефіцієнт дифузії, який чисельно дорівнює кількості речовини, яка дифундує за одиницю часу через переріз одиничної площі за умови одиничного градієнта концентрації. Розмірність
– коефіцієнт дифузії, який чисельно дорівнює кількості речовини, яка дифундує за одиницю часу через переріз одиничної площі за умови одиничного градієнта концентрації. Розмірність 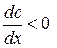 . З рівняння 2.1 випливає, що швидкість дифузії визначається як:
. З рівняння 2.1 випливає, що швидкість дифузії визначається як: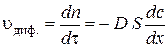 .
.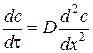 . (2.2)
. (2.2) , а
, а  . Отже, за стаціонарної дифузії концентрація речовини, що дифундує, зменшується у напрямку дифузії за лінійним законом.
. Отже, за стаціонарної дифузії концентрація речовини, що дифундує, зменшується у напрямку дифузії за лінійним законом.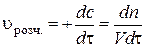 , (2.3)
, (2.3) (рис. 2, а).
(рис. 2, а).

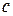 за лінійним законом. Якщо товщина дифузійного шару дорівнює
за лінійним законом. Якщо товщина дифузійного шару дорівнює  , то градієнт концентрації можна виразити як
, то градієнт концентрації можна виразити як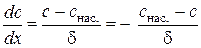 , (2.4)
, (2.4) . (2.5)
. (2.5)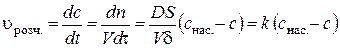 , (2.6)
, (2.6)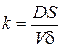 – константа швидкості розчинення;
– константа швидкості розчинення; 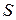 – площа поверхні контакту фаз;
– площа поверхні контакту фаз;  – коефіцієнт дифузії речовини у розчині. З рівняння (2.6) випливає, що у випадку, коли процес розчинення твердої речовини у рідині лімітується стадією стаціонарною дифузії, він описується кінетичним рівнянням першого порядку.
– коефіцієнт дифузії речовини у розчині. З рівняння (2.6) випливає, що у випадку, коли процес розчинення твердої речовини у рідині лімітується стадією стаціонарною дифузії, він описується кінетичним рівнянням першого порядку.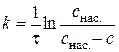 . (2.7)
. (2.7)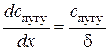 . (2.9)
. (2.9)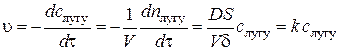 . (2.10)
. (2.10) –
–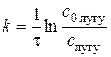 , (2.11)
, (2.11)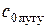 – початкова концентрація розчину лугу;
– початкова концентрація розчину лугу; 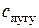 – концентрація цього розчину в момент часу
– концентрація цього розчину в момент часу 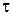 .
.


