ЕЛЕКТРОПРОВІДНІСТЬ РОЗЧИНІВ ЕЛЕКТРОЛІТІВ
Електропровідність характеризує здатність середовища проводити електричний струм. Вона є величиною, оберненою електричному опору, і вимірюється в сіменсах (См = Ом -1). Електропровідність розчину електроліту зумовлена міграцією наявних у даному розчині іонів і визначається як кількістю цих іонів, так і швидкістю їх руху в електричному полі. Зазвичай електропровідність електролітних систем обчислюють, вимірюючи опір електрохімічної комірки, що містить два платиновані платинові електроди і досліджуваний розчин. Для запобігання електролізу, який призводить до зміни концентрації розчину та поляризації електродів, при вимірюванні електричного опору комірки застосовують змінний струм, використовуючи так звані мости змінного струму. Опір будь-якого провідника струму розраховують за рівнянням:
де Величина, яка є оберненою питомому опору, називається питомою електропровідністю і позначається грецькою літерою
і має розмірність Ом -1×м -1 = См/м (у СІ) або Ом -1×см -1 = См/см (у системі СГС). Питома електрична провідність – це електропровідність об’єму розчину, який міститься між двома плоскими паралельними електродами одиничної площі, що розташовані на одиничній відстані один від одного. Вона залежить від природи електроліту та розчинника, концентрації розчину і температури. Концентраційна залежність æ і для сильних, і для слабких електролітів зазвичай проходить через максимум. В розведених розчинах будь-яких електролітів внаслідок збільшення концентрації æ зростає внаслідок збільшення кількості іонів, які переносять електричний заряд. Після досягнення певної концентрації æ починає спадати, оскільки в розчинах сильних електролітів посилюється взаємодія між протилежно зарядженими іонами і швидкість їх руху сповільнюється, а у розчинах слабких електролітів доволі стрімко зменшується їх ступінь дисоціації. На відміну від металевих провідників опір електролітних розчинів внаслідок підвищення температури у переважній більшості випадків зменшується, тобто електропровідність зростає. Основною причиною цього є температурне зменшення в’язкості рідкого середовища. Молярною (еквівалентною) електричною провідністю
Для 1–1-зарядних електролітів значення молярної і еквівалентної електропровідностей збігаються. Для електролітів інших валентних типів молярна електропровідність дорівнює добутку еквівалентної електропровідності та числа еквівалентів у одному молі речовини. У СІ молярну електропровідність обчислюють за формулою:
і вимірюють у См×м 2/моль. У системі СГС, в якій концентрацію зазвичай виражають у моль/дм3, а питому електропровідність – у См/см, рівняння (3.3) набуває вигляду:
і молярна електропровідність має розмірність См×см 2/моль. Молярна електропровідність залежить від таких самих факторів, що і питома. Внаслідок підвищення температури вона зростає. Збільшення концентрації розчину призводить до зменшення Швидкість руху іона у розчині
де
в якому В розчинах слабких електролітів а в розчинах сильних електролітів, у яких
За умови нескінченного розведення для будь-якого електроліту
де В розчинах слабких електролітів швидкість міграції іонів практично не залежить від їх кількості, тобто
Для сильного електроліту з формул (3.6) і (3.7) випливає, що
де Константа рівноваги процесу електролітичної дисоціації (константа дисоціації) визначається за законом розведення Оствальда. Так, для дисоціації бінарного 1–1-зарядного електроліту
константа дисоціації
Якщо початкова концентрація електроліту дорівнює
Константа дисоціації слабкого електроліту, як будь-яка константа рівноваги, є сталою величиною за умови
|

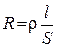 , (3.1)
, (3.1)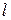 – довжина провідника (для розчинів – відстань між електродами);
– довжина провідника (для розчинів – відстань між електродами); 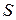 – площа поперечного перерізу провідника (площа електродів);
– площа поперечного перерізу провідника (площа електродів);  – питомий опір, який дорівнює опору провідника з одиничними довжиною та площею перерізу.
– питомий опір, який дорівнює опору провідника з одиничними довжиною та площею перерізу.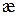 («каппа»). З рівняння (3.1) випливає, що
(«каппа»). З рівняння (3.1) випливає, що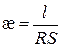 (3.2)
(3.2) («лямбда») називається електропровідність об’єму розчину, який містить 1 моль (1 моль-екв) електроліту і знаходиться між двома паралельними електродами, що розташовані на одиничній відстані один від одного. Об’єм такого розчину залежить від його концентрації і називається розведенням розчину. Розведення розчину
(«лямбда») називається електропровідність об’єму розчину, який містить 1 моль (1 моль-екв) електроліту і знаходиться між двома паралельними електродами, що розташовані на одиничній відстані один від одного. Об’єм такого розчину залежить від його концентрації і називається розведенням розчину. Розведення розчину 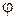 – величина, яка обернена молярній концентрації
– величина, яка обернена молярній концентрації 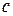 :
: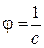 .
.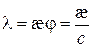 (3.3)
(3.3)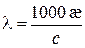 , (3.4)
, (3.4)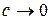 молярна електропровідність набуває максимального за певної температури значення
молярна електропровідність набуває максимального за певної температури значення 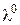 , яке називають граничною молярною електропровідністю.
, яке називають граничною молярною електропровідністю. 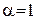 ) і відсутністю взаємодії між іонами сильного електроліту (середній іонний коефіцієнт активності електроліту
) і відсутністю взаємодії між іонами сильного електроліту (середній іонний коефіцієнт активності електроліту 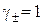 ).
).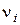 [м/с] прямо пропорційна напруженості електричного поля
[м/с] прямо пропорційна напруженості електричного поля 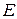 [В/м]:
[В/м]: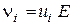 ,
,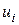 – абсолютна швидкість руху іона
– абсолютна швидкість руху іона 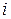 (за умови
(за умови  В/м). Молярна електропровідність або рухливість іона
В/м). Молярна електропровідність або рухливість іона 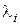 пов’язана з
пов’язана з 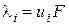 ,
,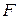 – стала Фарадея.
– стала Фарадея.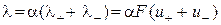 , (3.5)
, (3.5)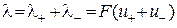 . (3.6)
. (3.6) , і рівняння (3.5) і (3.6) записуються як
, і рівняння (3.5) і (3.6) записуються як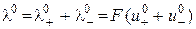 , (3.7)
, (3.7)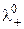 і
і  – граничні рухливості катіона та аніона, відповідно;
– граничні рухливості катіона та аніона, відповідно; 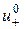 і
і 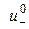 – абсолютні швидкості руху зазначених іонів у гранично розведеному розчині. Вираз (3.7) є математичним відображенням закону незалежного руху іонів Кольрауша, згідно з яким молярна електропровідність нескінченно розведеного розчину електроліту дорівнює сумі граничних іонних рухливостей. Фізичний зміст цього закону полягає в тому, що в зазначеному розчині іони переносять струм незалежно один від одного, тобто їх рухливості за певної температури є сталими і не залежать від природи протилежно зарядженого іона. Граничні молярні електропровідності іонів у воді за стандартної температури наведено в довіднику.
– абсолютні швидкості руху зазначених іонів у гранично розведеному розчині. Вираз (3.7) є математичним відображенням закону незалежного руху іонів Кольрауша, згідно з яким молярна електропровідність нескінченно розведеного розчину електроліту дорівнює сумі граничних іонних рухливостей. Фізичний зміст цього закону полягає в тому, що в зазначеному розчині іони переносять струм незалежно один від одного, тобто їх рухливості за певної температури є сталими і не залежать від природи протилежно зарядженого іона. Граничні молярні електропровідності іонів у воді за стандартної температури наведено в довіднику.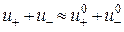 . З урахуванням цього факту на підставі рівнянь (3.5) та (3.7) для слабкого електроліту можна записати:
. З урахуванням цього факту на підставі рівнянь (3.5) та (3.7) для слабкого електроліту можна записати: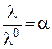 . (3.8)
. (3.8) , (3.9)
, (3.9)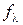 – коефіцієнт електропровідності, який враховує міжіонну взаємодію.
– коефіцієнт електропровідності, який враховує міжіонну взаємодію.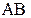 за схемою
за схемою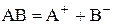

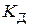 має вигляд:
має вигляд: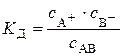 .
. , то згідно із законом розведення Оствальда
, то згідно із законом розведення Оствальда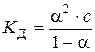 . (3.10)
. (3.10)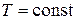 .
.


