Дәріс тақырыбы: Активтену энергиясы. Массалар әрекеттесу заңының қолданылу шектері.
Дәріс тезистері:Конкуренттік реакцияның өту тереңдігін сипаттайтын шаманы K0= термодинамикалық константа деп аталады. А ктивтілік дегеніміз – берілген реалды ерітіндінің термодинамикалық қасиетіне сәйкес қасиетке ие идеал ерітіндінің компонентінің концентрациясы. Оның өлшем бірлігі [моль/л]. Бұл теңдеуді аА+bB=cC+dD реакциясына қойып, түрлендіру жүргізгеннен кейін мынаны аламыз: K0= Бұл қатынас МӘЗ-ның берілуі болып табылады. Активтілік коэффициенті деп бөлшектің активтілігінің оның концентрациясына қатынасын айтады: fA= aA / [A]. Электролит ерітіндідегі иондардың активтілік коэффициенті жүйенің электростатикалық әрекеттесуінің өлшемі қызметін атқарады. Олар I шамасына, яғни иондық күшіне тәуелді. Ол былай есептеледі: I= Жеке иондардың активтілік коэффициентін Дебай-Хюккельдің жуықталған формулалары арқылы табуға болады. lg fi= - AZi2 1923 жылы Бренстед пен Лоури қышқылдар мен негіздердің протолиттік теориясын ұсынды. Осы теорияға сәйкес қышқыл дегеніміз протонды беріп жіберетін, ал негіз дегеніміз протонды, қосып алатын заттар. Льюис теориысы бойынша қышқыл-негіздік әрекеттесулерге комплекстүзілу реакцияларын жатқызуға болады, өйткені олар да донорлы-акцепторлы байланысқа негізделген. 1939 жылы Усанович барлық қышқыл мен негіздің жалпы теориясын ұсынды. Қышқылдар – катиондарды беріп жіберуге және аниондар мен электрондарды қосвп алуға қабілетті заттар. Негіздер –аниондар мен электрондарын беріп жіберетін және катиондарды қосып алатын заттар. Кемшілігі: қышқылдар мен негіздерге кез-келген химиялық затты жатқызады, және кез-келген химиялық реакцияқышқыл мен негіз арасындағы реакция болып табылуы. Онда тотығу-тотықсыздану реакциясын да қышқыл-негіздік әрекеттесуге жатқызу керек болып табылар еді: 2Fe3+ + Sn2+ «2Fe2+ + Sn4+. қышқыл негіз қышқыл негіз Ал протолиттік теорияның мұндай кемшілігі жоқ. Протолиттік теория тек қана сулы ерітінділер үшін ғана емес, сонымен қоса газтектес заттар үшін де қолданылады. Күшті қышқыл диссоциациясы: HA + SH «SH2+ + A-, Әлсіз қышқыл диссоциациясын жазайық: НА + Н2О «Н3О+ + А- не НА «Н+ + А-;
Күшті негіз диссоциациясын жазайық: В +Н2О «ВН+ + ОН- Әлсіз негіз: Буферлі ерітінділер. Буферлі ерітінді әлсіз қышқыл НА мен оның аттас иондас тұздары немесе әлсіз негіз В бен оның аттас иондас тұзының жұптарынан тұрады. Ол рН мәнін тұрақты ұстап тұру үшін қолданады. Әлсіз қышқыл НА мен ілеспелі негіз қоспасын МА алайық: НА + Н2О «Н3О+ + А- Н2О + Н2О «Н3О+ + ОН- МА «М+ + А- НА – әлсіз қыщқыл болғандықтан, онда
бұдан Әлсіз негіз бен ілеспелі қышқылдың қоспасын (В+В×НА): В + Н2О «ВН+ + ОН-,
Гидролиз. Еріген заттың сумен алмасу реакциясына түсіп, яғни диссосацияланған иондардың Н+ немесе ОН- иондарымен әрекеттесуін гидролиз деп атайды. 1.Егер тұз диссосацияланғанда аз полюстенетін катиондар және аниондар түзетін болса, ортаның рН-ы өзгермейді, гидролиз іс жүзінде жүрмейді: 2.Егер тұз күшті қышқыл мен әлсіз негізден түзілген болса, онда оның гидролизі сутек иондарының түзілуіне алып келеді, яғни ерітіндінің қышқылдығы артады,рН-тың мәні кемиді: 3.Егер тұз күшті негіз бен әлсіз қышқылдан түзілген болса, онда оның гидролизі гидроксид иондарының түзілуіне алып келеді, бұл ерітіндінің рН мәнін арттырады: 4.Әлсіз негіз бен әлсіз қышқылдан түзілген тұздардың гидролизі толық жүреді. Мөлшерлік жағынан гидролиз тұздардың гидролиздену дәнежесімен (һ) сипатталады: һ=(cг/c0)*100% Гидролиздену дәрежесі мен констансасы арасында төмендегі өрнекте көрсетілген қатынас бар: Һ=ÖКг. Реалды ерітінділерде ерігіштік көбейтіндісінің ерітіндінің иондық қүшіне тәуелділігін мына теңдеумен көрсетеміз: Нашар еритін қосылыстың ерігіштік көбейтіндісі оның ерігіштігімен қарапайым арақатынаспен байланысқан. Егер қанақ ерітіндіде MmAa қосылыстың ерігіштігі s моль/л болса, онда осы ерітіндідегі иондар концентрациясы [М]=mS және [А]=aS тең. Жоғарыдағы теңдеуге осы мәндерін қойып алатынымыз: ЕК=[mS]m[aS]a=mmaaSm+a немесе S = Негізгі [1-3], Қосымша [4-11]. Мерзімдік әдебиеттер [12-14] Электрондық оқулықтар мен оқу құралдары [15-16] Интернет көздері [17-20] Дәріс тақырыбы: Химиялық тепе-теңдік, иделды және реаллды жүйелер. Дебай-Хюккельдің теориясы. Реалды, термодинамикалық, шартты тепе-теңдік константалар. Күшті және әлсіз электролитттер. Дәріс тезистері: Ерітінді идеал деп аталады, егер ондағы кез-келген А және В бөлшектерінің сонымен қоса еріткіш молекулаларының әрекеттесу энергиясы Е тең және бөлшектің табиғатына тәуелсіз болса: ЕАА = ЕВВ = ЕАВ. Реалдық жүйеге әсер ететін факторлар екі негізгі топқа бөлінеді: электростатикалық және химиялық әрекеттесу. Бұл екеуінің арасындағы шек шартты түрде қабылданады. Мысалы, еріген заттың еріткіш молекулаларымен әрекеттесуінің нәтижесінде пайда болатын сольватациялық эффектінің табиғаты әдетте жартылай электростатикалық, жартылай химиялық болып келеді. 1. Электростатикалық әрекеттесу. Бұған (әрекеттесу энергиясының төмендеуі бойынша): иондар арасындағы кулондық әрекеттесулер, полярлы молекулалардың қатысуымен ион-дипольдік және диполь-дипольді әрекеттесулер, ерітіндіде кездесетін кез-келген бөлшектің ван-дер-вальстік әрекеттесулері жатады. Электростатикалық әрекеттесу энергиясы әрекеттесуші бөлшектердің табиғатына тәуелді екені белгілі: ЕАА Нейтрал моллекулалар үшін электростатикалық әрекеттесу күші салыстырмалы үлкен емес және тек қысқа аралықта байқалады, сондықтан бейэлектролит ерітінді қасиетінің идеалдылықтан ауытқуы тек өте жоғары концентрациялы ерітіндіде байқалады. Керісінше, ион аралық әрекеттесулер өте күшті және ұзақ аралықта байқалады. Сондықтан электролит ерітінділердің идеалдалықтан ауытқуы қүштірек байқалады және де тіпті біраз сұйытылған ерітінділерде де байқалады. 2. Химиялық әрекеттесу. Күрделі химиялық жүйелерде сол бір бөлшектер бірнеше тепе-теңдікке бір уақатта қатар қатысады. Мысалы, HgS –нің қаныққан сулы ерітіндісі HCl-мен әрекеттескенде Hg2+ және S2- иондары арасында бірнеше тепе-теңдік орнайды: гетерогенді HgS(қ)=Hg2+ + S2- (1) және гомогенді Нg2+ + Cl- = HgCl+ (2) Hg2+ + 4Cl- = HgCl42- S2- + H+ = HS- S2- + 2H+ = H2S (3)
Күрделі химиялық жүйелерді сипаттау үшін әдетте бір тепе-теңдікті (1) басты деп белгілейді, ал қалған тепе-теңдікті (2), (3) – қосалқы дейді, және қосалқы тепе-теңдіктердің басты тепе-теңдікке әсерін қарастырады. Бұл – күрделі химиялық жүйелерді, соның ішінде тіпті өте қиын не есепке алуға мүмкін емес химиялық тепе-теңдік жүйелерін әлдеқайда оңай және біркелкі сипаттауға мүмкіндік береді. Мұндай әдістің келесі артықшылығы – бірегей позициядан әрі химиялық, әрі электростатикалық эффектілерді сипаттау болып табылады. Материалдық баланс теңдеуі. Изоляцияланған жүйеде атаомдар саны өзгермейді. (МӘЗ). Мысалы, Hg (II) – ның тұзқышқылды ерітіндісінде қорғасын атомы бар барлық бөлшектердің жалпы концентрациясы тұрақты және мынаған тең: CHg=[Hg2+]+[HgCl+]+[HgCl2]+ [HgCl3-]+[HgCl42-] (4) Жалпы жағдайда материалдық баланс теңдеуін жазғанда стехиометриялық қатынасты есепке алу керек. Мысалы, CrO42-, HCrO4-, H2CrO4, Cr2O72-,HCr2O7- формасындағы Cr(IV) құрамды ерітінді үшін материалдық баланс теңдеуі төмендегідей (назар аударыңыз: Cr2O72- және HCr2O7- бөлшектерінің концентрацияларының алдында 2 стехиометриялық коэффициенті тұр): ССr=[ CrO42-] + [ HCrO4-] + [ H2CrO4] + 2[Cr2O72-] + 2[ HCr2O7-] Электронейтралдық теңдеу. Жабық жүйеде оң зарядтардың жалпы саны теріс зарядтардың жалпы санына тең (зарязттардың сақталу заңы):
Мұнда [Ai] – і ионының тепе-теңдік концентрациясы, Zi – оның заряды (таңбасын есептегенде!), ал қосынды ерітіндіде болатын барлық иондар бойынша жүргізіледі. Мысалы, Са(HCO3)2 сулы ерітіндісінің Са2+, НСО3-, СО32-, Н+ және ОН- иондары бар, оның электронейтрал теңдеуі келесідей: 2[Са2+] – [НСО3-] - 2[СО32-] – [Н+] – [ОН-] =0 Материалдық баланс теңдеуі де, электронейтралдық теңдеуі де бөлшектің өзара концентрацияларын (активтіліктерін емес) байланыстырады.
Берілген бір химиялық формадағы атомның молдік үлесін есептегенде, стехиометрилық қатынасты ескеру керек. Мысалы, хромның С2О72- бөлшек түріндегі молдік үлесі мынаған тең:
Міне осылай Әрекеттесуші бөлшектердің активтіктері арқылы сипатталатын тепе-теңдік константасы K0= термодинамикалық константа деп аталады. Идеалды және идеалды емес жүйелер үшін термдинамикалық константа тек қана температураға, қысымға, еріткіш табиғатына тәуелді. (5)-ке сәйкес бөлшектің активтілігінің орнына тепе-теңдік концентрациясының өрнегін: К= және жалпы концентрацияның өрнегін жазайық: K’= Бұл өлшемдер тепе-теңдіктің концентрациялық константасы деп аталады. К - реалды, ал К' – шартты тепе-теңдік константасы. Реалды жуйелер үшін концентрациялық константа мәні көптеген факторларға байланысты. К мен К` шамасын (6)және(9) –ке қойып K0 арқылы есептейік: К= K’= (10), (11) теңдеуден К температураға, қысымға, еріткіш табиғатына (К0 шамасына әсер етеді) тәуелді, және ерітіндінің иондық күшіне тәуелді екенін (f шамасына әсер етеді) көреміз, сонымен қатар конкуренттік реакцияның өту тереңдігіне де ( Осы үш түрлі тепе-теңдік константаларының ішінде К0өте аз факторларға тәуелді, сондықтан епе-теңдіктің фундаменталды сипаттамасы болып табылады. Міне, осыған байланысты термодинамикалық константа шамаларын анықтама құралдарында көп келтіреді. Бірақ та, химик-аналитик үшін концентрациялық константаның маңызы зор, өйткені тек солар ғана берілген реалды жүйені сипаттайды. Алдын-ала f, 1) Егер конкуренттік реакцияның әсерін елемеуге болатындай болса, онда 2) Егер сонымен қатар электростатикалық әрекеттесуді елемеуге болатындай болса(мысалы, сұйытылған ерітіндіде), онда барлық f=1 және K`=K=K0. Бұл жағдайда термодинамикалық константаның кестедегі мәнін пайдалануға болады. 3) Электростатикалық әрекеттесудің химиялық әрекеттесулерге қарағанда әсері аз байқалады. К0 және К шамаларының айырмашылығы 1-2 реттен аспайды, ал K`және K-дан 10 және одан да жоғары реттен асады. Сондықтан электростатикалық әрекеттесулердің әсерін жиі ескермейді. K=K0 деп тек қана Негізгі [1-3], Қосымша [4-11]. Мерзімдік әдебиеттер [12-14] Электрондық оқулықтар мен оқу құралдары [15-16] Интернет көздері [17-20]
Дәріс тақырыбы: Активтілік. Қышқылды-негіздік теориялар. Активтілік, активтілік коэффициент, ерітіндінің иондық күші. Қышқылдар мен негіздердің (Бренстед-Лоури) теориялары. Дәріс тезистері:Көптеген заттар (МА деп белгілейік) суда ерігенде және гидраттанған қабық түзгеннен кейін өзгеріске ұшырайды. Нәтижесінде ерітіндіде гидраттанған иондар – катиондар М+*nH2O және аниондар А-*nH2O түзіледі. Сулы ерітіндіде гидраттанған иондардың пайда болу процессін электролиттік диссоциация дейді (Аррениус бойынша). Суда ионды кристалды заттардың (М+)(А-) электролиттік диссоциациялануы қайтымсыз процес: (М+)(А-)=М+(р+А- (р) Мұндай заттар күшті электролиттерге жатады. Мысалы: NaOH=Na+ + A-, K2SO4=2K+ + SO42- Ковалентті полюсті моллекулалардан тұратын заттардың электролиттік диссоциациялануы қайтымда процесс: (М - А) HNO2 CH3COOH NH3*H2O Күшті электролиттер 30%-тен артық диссоциацияланатындар. Оларға тұз, күкірт, азот, хлор, т.б. қышқылдар сілтілер, суда ерімтал тұздар жатады. Әлсіз электролиттер осы еріткіштердің өзіде 3% -тен кем диссоциацияланады. Мысалы, көмір, көгерткіш, бор қышқылдары, аммиак, көптеген органикалық қышқылдар және негіздер. Орташа электролиттердің диссоциациялану дәрежесі 3 -30%-ке дейінгі аралықта. Электролиттік диссоциациялану дәрежесі
Электростатикалық әрекеттесу жүйенің идеалдылықтан ауытқуына әкеледі. Электростатикалық факторлардың әсерін есепке алғанда активтік әдіс деп аталатын тәсіл арқылы жүргізуге болады. Оның негізі мынада: әрекеттесуші бөлшектердің концентрацияларының орнына [A] активтілік аА деп аталатын шамалар қолданылады. Активтіліктің сандық мәнін еркін энергия үшін функционалдық тәуелділіктің формасы реалды ерітіндіде де сақталынатындай қылып алады: GA=G0A + nRTln aA (4) Міне, активтілік дегеніміз – берілген реалды ерітіндінің термодинамикалық қасиетіне сәйкес қасиетке ие идеал ерітіндінің компонентінің концентрациясы. Оның өлшем бірлігі [ моль/л]. (4) теңдеуді аА+bB=cC+dD реакциясына қойып, түрлендіру жүргізгеннен кейін мынаны аламыз: K0= Бұл қатынас МӘЗ-ның берілуі болып табылады. Бірақ та бұл өрнек кез-келген жүйе үшін- реалды да, идеалды да жүйе үшін қолданылады. Жалпы алғанда массалық әрекеттесу заңы (МӘЗ) былай тұжырымдалады: Активтілік коэффициенті деп бөлшектің активтілігінің оның концентрациясына қатынасын айтады: fA= aA / [A] (6) Электролит ерітіндідегі иондардың активтілік коэффициенті жүйенің электростатикалық әрекеттесуінің өлшемі қызметін атқарады. Идеал ерітінділер үшін электростатикалық әрекеттесулер ескермеуге болатындай тым аз шама, активтілік олардың концентрациясына тең және f=1. Активтілік коэффициентті анықтап есептеудің әртүрлі әдістері бар. Электростатикалық әрекеттесулер электролит ерітіндіде әсіресе күшті болғандықтан, біз иондардың активтілік коэффициентін есептеуге көп назар аударуымыз керек. Олар I шамасына, яғни иондық күшіне тәуелді. Ол былай есептеледі: I= Мұндағы Zi – Ai ионының заряды, Міне, иондық күш ерітіндіде болатын барлық электростатикалық әрекеттесулерді ескереді. Жеке иондардың активтілік коэффициентін Дебай-Хюккельдің жуықталған формулалары арқылы табуға болады. lg fi= - AZi2 lg fi= Мұндағы А және В - еріткіш температурасы мен диэлектрлік өткізгіштігіне тәуелді константалар (су үшін 298 К-де А~0.5 және В ~0,33 тең); а – эмперикалық константа, ол иондардың өлшемін ескереді және иондарды қатаң сфера деп жорамалдағанда сольваттанған иондардың орташа арақашықтығын сипаттайды. а шамасын тұрақты деп есептеуге болады, ол ионның табиғатына тәуелсіз және шамамен 3А0-ге тең.Егер дәлділікпен есептеу қажеттігі туса онда а-ның кестедегі мәнін алуға болады I<0.1 болғанда бірдей зарядты иондардың өлшемі әр түрлі болса да fi шамасы айтарлықтай өзгермейді. Сондықтан бірдей зарядты иондардың өлшемін ескермей, орташаланған fi шамасымен есептеу жүргізуге болады. Сұйытылған ерітіндіде (I<0.1М) иондардың активтілік коэффициенті бірден кіші және иондық күші өскен сайын төмендейді: I Иондық күші үлкен болған сайын активтілік коэффициент иондардың табиғатына, ал содан кейін ерітіндінің жалпы құрамына тәуелді бола бастайды. Бұндай жағдайда активтілік коэффициентті табу үшін нақты анықтама құралдарына жүгіну керек. Өте концентрлі ерітіндіде (I>1 М) активтілік коэффициент бірден үлкен болуы мүмкін. Бұл құбылыстың бір себебі иондар сольватациясының әсерінен концентрацияның жоғарылауы болып табылады. I=0.1 – 0.5 болғанда Дэвистің теңдеуі жақсы нәтиже көрсетеді: lg fi=- Мұндағы Эксперимент жүзінде жеке иондардың активтілік коэффициентін есептеу мүмкін емес, өйткені тек қана бір түрлі иондардан тұратын ерітінді дайындау мүмкін емес. AmBn электролитінің коэффициенттерін есептеуге болады: f Бұл формуланы (8), (9), (10) - мен қатар алып электролиттің орташа активтілік коэффициентін сипаттауға болады. (8),(9),(10)- формулалары зарядталмаған (бейэлектролит) молекулалардың да активтілік коэффициенттерін де анықтауға мүмкіндік береді. Бұл жағдайда Zi=0 екені белгілі. Бұл шаманы (8),(9) теңдеуге қойса fi=1, I lg fi=СІ (12) шығады. Бұл жағдайда С константасы тұздық коэффициент деп аталады. Ол бейэлектролиттің диэлектрлік өткізгіштігіне Диэлектрлік өткізгіштігі жоғары заттар үшін (мысалы, НСN үшін Аррениустың классикалық теориясы. Қышқылдар деп диссоциацияланғанда сутегі ионы Н+ түзілетін, ал негіздер деп – диссоциациланғанда гидроксид-ионы ОН-түзілетін затты айтамыз. 1923 жылы Бренстед пен Лоури қышқылдар мен негіздердің протолиттік теориясын ұсынды. Осы теорияға сәйкес қышқыл дегеніміз протонды беріп жіберетін, ал негіз дегеніміз протонды, қосып алатын заттар. Қышқыл-негіздік әрекеттесулер нәтижесінде донорлы-акцепторлы байланыс түзіледі. Қышқылдар: HCl, CH3COOH, BCl3, AlBr3, SnCl4. Бензолды ерітіндіде күлгін түсті кристалды индикаторды сары түске бояйды. Негіздер: аммиак NH3, амин, пиридин, спирттер, жай және күрделі эфирлер индикаторды күлгін түске бояйды. Льюис теориысы бойынша қышқыл-негіздік әрекеттесулерге комплекстүзілу реакцияларын жатқызуға болады, өйткені олар да донорлы-акцепторлы байланысқа негізделген. 1939 жылы Усанович барлық қышқыл мен негіздің жалпы теориясын ұсынды. Қышқылдар – вещества, катиондарды беріп жіберуге және аниондар мен электрондарды қосвп алуға қабілетті заттар. Негіздер –аниондар мен электрондарын беріп жіберетін және катиондарды қосып алатын заттар. Кемшілігі: қышқылдар мен негіздерге кез-келген химиялық затты жатқызады, және кез-келген химиялық реакцияқышқыл мен негіз арасындағы реакция болып табылуы. Онда тотығу-тотықсыздану реакциясын да қышқыл-негіздік әрекеттесуге жатқызу керек болып табылар еді: 2Fe3+ + Sn2+ «2Fe2+ + Sn4+. қышқыл негіз қышқыл негіз Ал протолиттік теорияның мұндай кемшілігі жоқ. Протолиттік теория тек қана сулы ерітінділер үшін ғана емес, сонымен қоса газтектес заттар үшін де қолданылады. Протолиттер. Протолиттік теория бойынша қышқылдар –протонды беріп жіберетін,яғни протонның доноры болыды; негіздер – протонынды қосып алатын,яғни протон акцепторы болады. Онда, егер А – қышқыл, В – негіз болса, онда мына қорытынды жасауға болады: А «Н+ + В (1) Қарапайымдылық үшін қышқыл мен негіздің заряды көрсетілмеген. Процесс (1) қайтымды, және кей жағдайда қышқыл негізге айнала алады және керісінше. Теңдеу (1) Қышқыл мен негіздің бір-бірімен байланысты екенін көрсетеді. Әр қышқылға протон бөлінгенде өзінің негізі сәйкес.Және әр негізге протон қосып алынғанда өзінің қышқылы сәйкес. Міне осындай жұпты қышқыл-негіздік не протолиттік жұп дейді, ал протолиттік жұптың әрбір компоненті ілеспелі протолит болып табылады: Протолиттік жұптың мысалдары: қышқыл негіз HCl «H+ + Cl- Н2CO3 «H+ + HCO3- HCO3- «H+ + CO32- H2O «H+ + OH- H3O+ «H+ + H2O NH4+ «H+ + NH3 [Zn(OH2)n]2+ «H+ + [Zn(OH)(OH2)n-1]+ [Zn(OH)(H2O)n-1]+ «H+ + [Zn(OH)2(OH2)n-2] Протолиттер арасындағы химиялық әрекеттесулер екі протолиттік жұп арасында жүреді: А1 «Н+ + В1 В2 + Н+ «А2 А1 + В2 «В1 + А2 Бұл протолиттік реакцияда: А1 – қышқыл I, қышқыл; В2 – негіз II, негіз; А2 – қышқыл II, ілеспелі қышқыл; В1 - негіз I, ілеспелі негіз. Күшті және әлсіз протолиттер. Қышқыл мен негіздің күші еріткіштің қышқыл-негіздік табиғатына тәуелді. Міне,
Негізгі [1-3], Қосымша [4-11]. Мерзімдік әдебиеттер [12-14] Электрондық оқулықтар мен оқу құралдары [15-16] Интернет көздері [17-20]
Дәріс тақырыбы: Сутектік көрсеткіш. Күшті және әлсіз қышқылдар мен негіздердің рН есептеу. Дәріс тезистері:Қышқыл-негіздік тепе-теңдік – гомогенді жүйенің тепе-теңдігінің жеке жағдайы, сондықтан тепе-тнңдік концентрациясының есептеулері массалық әрекеттесу заңы мен материалдық баланс теңдеуімен жүргізіледі. рН-мәнін есептеу химик-аналитиктің көп жасайтын опнрациялардың бірі. Ол анализ жүруінің жағдайын анықтау үшін, индикатор таңдау үшін, титрлеу қисығын құру үшін, нашар еритін қосылыстардың тұнбаға түсу және комплекстүзілу шартын білу үшін қажет. Күшті қышқыл. Күшті қышқыл диссоциациясы: HA + SH «SH2+ + A-, Сулы ерітіндіде: НА + Н2О «Н3О+ + А-. Қарапайым жазу үшін SH2+ (не Н3О+) орнына Н+ деп жазамыз: НА «Н+ + А- (1) Ерітіндіде су автопротолизінің реакциясы орын алады: Н2О + Н2О «Н3О+ + ОН- немесе Н2О «Н+ + ОН-,(2)
Электронейтралдық теңдеу: Теңдеудің сол жағында қышқал мен судың диссоциациясынан болатын протондар ескерілген:
Біз квадраттық теңдеу аламыз: Квадраттық теңдеудің х –ке қатысты не
НА –күшті қышқыл болғандықтан, ерітіндіде ол толық диссоциацияланған және
(7) теңдеу – жалпы түрдегі нақты математикалық өрнек. егер
Әлсіз қышқыл Әлсіз қышқыл диссоциациясын жазайық: НА + Н2О «Н3О+ + А- не НА «Н+ + А- Н2О + Н2О «Н3О+ + ОН- не Н2О «Н+ + ОН-
Электронейтралдық шарты:
Бұдан:
Қышқыл әлсіз болғандықтан
(11) теңдеуі- жалпы көрінісі. Егер
Көпнегізді қышқыл. Көпнегізді қышқыл протолизі сатылай жүреді және әр саты өзіндік сатылы қышқылдық константасымен сипатталады.Қышқылдық константалардың мәндері 104 – 105 есе аралығында ерекшеленеді. Фосфор қышқылы үшін: Н3РО4 + Н2О «Н3О+ + Н2РО4-, К1 = 7,1×10-3 Дата добавления: 2015-09-15; просмотров: 8702. Нарушение авторских прав; Мы поможем в написании вашей работы! Оценка качества Анализ документации. Имеющийся рецепт, паспорт письменного контроля и номер лекарственной формы соответствуют друг другу. Ингредиенты совместимы, расчеты сделаны верно, паспорт письменного контроля выписан верно. Правильность упаковки и оформления....
Виды и жанры театрализованных представлений
Проживание бронируется и оплачивается слушателями самостоятельно...
|

 - коэффициент не мольдік үлес деп атайды:
- коэффициент не мольдік үлес деп атайды: 

 , мұндағы Zi – Ai ионының заряды,
, мұндағы Zi – Ai ионының заряды,  - ерітіндіде кездесетін барлық иондардың қосындысы.
- ерітіндіде кездесетін барлық иондардың қосындысы. (I
(I  0,1М), lg fi=
0,1М), lg fi=  (I = 0.01 – 0.1)
(I = 0.01 – 0.1) (1)
(1) (2)
(2) (3)
(3) ,
, 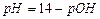 .
. .
. ; МА толық диссоциацияланғандықтан,
; МА толық диссоциацияланғандықтан,  . Сонда:
. Сонда: ,
,  ,
, .
. бұдан
бұдан  ,
,
 ∆nZ2A[-0,2J+J0,5/(1+J0,5)], мұндағы ∆nZ2 =mZ2+aZ2
∆nZ2A[-0,2J+J0,5/(1+J0,5)], мұндағы ∆nZ2 =mZ2+aZ2

 Zi[Ai]=0 (5)
Zi[Ai]=0 (5) (7)
(7)
 (8)
(8) (9)
(9) =
=  (10)
(10) =
= 

 (11)
(11) М+ (р + А- (р) Мұндай заттар әлсіз электролиттерге жатады.Мысалы:
М+ (р + А- (р) Мұндай заттар әлсіз электролиттерге жатады.Мысалы: деп, иондарға ыдыраған моллекулалар санының еріген электролит моллекуласының жалпы санына қатынасын айтады:
деп, иондарға ыдыраған моллекулалар санының еріген электролит моллекуласының жалпы санына қатынасын айтады: =с дисс/сжалпы
=с дисс/сжалпы (5)
(5) (7)
(7) - ерітіндіде кездесетін барлық иондардың қосындысы.
- ерітіндіде кездесетін барлық иондардың қосындысы.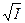 (I
(I  (I = 0.01 – 0.1) (9)
(I = 0.01 – 0.1) (9) 0, fi
0, fi  +CI (10)
+CI (10) және С – константалар (нақты электролит үшін эмпирикалық іздейді).
және С – константалар (нақты электролит үшін эмпирикалық іздейді). =
=  (11)
(11) тәуелді. Диэлектрлік өткізгіштігі төмен заттар үшін (газ, қант, ақуыз) С>0, және f>1. Бұндай заттарда «тұзсыздану» (высаливание) эффектісі байқалады, яғни суда электролиттің қатысуында оның ерігіштігінің төмендеуі.
тәуелді. Диэлектрлік өткізгіштігі төмен заттар үшін (газ, қант, ақуыз) С>0, және f>1. Бұндай заттарда «тұзсыздану» (высаливание) эффектісі байқалады, яғни суда электролиттің қатысуында оның ерігіштігінің төмендеуі. , константаның мәні еріген протолиттің (
, константаның мәні еріген протолиттің ( ) қышқылдық қасиетіне де, еріткіштің негіздік қасиетіне (
) қышқылдық қасиетіне де, еріткіштің негіздік қасиетіне (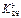 ). Сондықтан еріткіштің негіздік қасиеті басым болған сайын протолиттің қышқылдық күші басым болады. Еріткіштің негіздік қасиеті басым болған сайын қышқыл көбірек диссоциацияға ұшырайды және негіздер азырақ диссоциацияланады.
). Сондықтан еріткіштің негіздік қасиеті басым болған сайын протолиттің қышқылдық күші басым болады. Еріткіштің негіздік қасиеті басым болған сайын қышқыл көбірек диссоциацияға ұшырайды және негіздер азырақ диссоциацияланады. мәні еріген протолиттің негіздік қасиетіне (
мәні еріген протолиттің негіздік қасиетіне ( ) де еріткіштің қышқылдық қасиетіне (
) де еріткіштің қышқылдық қасиетіне ( ) де тәуелді. Еріткіштің қышқылдық қасиеті басым болған сайын, берілген протолиттің негіздік қасиеті басым болады. Қышқылдық қасиеті басым еріткіштер негіздердің диссоциациясынкүшейтеді де, қышқылдардікінің азайтады.
) де тәуелді. Еріткіштің қышқылдық қасиеті басым болған сайын, берілген протолиттің негіздік қасиеті басым болады. Қышқылдық қасиеті басым еріткіштер негіздердің диссоциациясынкүшейтеді де, қышқылдардікінің азайтады. (3)
(3) (4)
(4) , өйткені
, өйткені  (3)
(3) немесе
немесе (5)
(5) ;
;  .
. түбірін табамыз:
түбірін табамыз: (6)
(6) . Онда:
. Онда: (7)
(7) (мысалы,егер ерітінді концентрациясы 1×10-4 - 1×10-5моль/л көп болса), онда 4Кw шамасын ескермеуге болады, (7)теңдеу қарапайымдалады:
(мысалы,егер ерітінді концентрациясы 1×10-4 - 1×10-5моль/л көп болса), онда 4Кw шамасын ескермеуге болады, (7)теңдеу қарапайымдалады: (8)
(8) (9)
(9)

 (10)
(10) .
. :
: ,
, (11)
(11) (қышқыл соншама әлсіз болмаса не ерітінді көп сұйылтылмаса), онда:
(қышқыл соншама әлсіз болмаса не ерітінді көп сұйылтылмаса), онда: (12),
(12),  (13)
(13)


