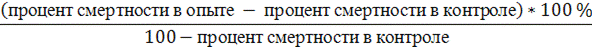Цериодафнии как тест-объект для токсикологических исследований.
Ветвистоусые рачки родов Daphnia и Ceriodaphnia широко распространены в водоемах, поэтому легко доступны для исследования. Они имеют небольшие размеры, не требовательны, высоко плодовиты и имеют короткий цикл развития. Тело их заключено в прозрачную камеру (карапакс), благодаря чему есть возможность на живых экземплярах наблюдать процесс созревания яиц в гонадах, прохождение пищи по пищеварительному тракту, дыхательные движения, ритм сердцебиения. Эти показатели являются весьма важными при постановке токсикологических опытов для оценки степени токсичности и механизма действия веществ [23]. Кроме того, их использование в качестве тест-организмов для биотестирования рекомендовано для государственного экологического контроля [20]. Рачки вида Ceriodaphnia affinis обитают в пресноводных водоемах Европы, Северной Америки, Азии, Северной Африки. Этот вид относится к олиго- и бетамезосапробам и населяет водоемы с замедленным течением (неглубокие озера, реки, водохранилища). Цериодафнии имеют сравнительно мелкие размеры (половозрелые самки – 1,5 мм, самцы – 0,8 мм), что позволяет в опытах манипулировать с меньшими объемами воды и более компактными емкостями. Биологический цикл развития от рождения до половозрелости у цериодафний короток при оптимальных условиях развития. Так, при температуре 25oС созревание наступает на 2-3-и сутки от рождения, время первого помета – на 3-4-е сутки, а за срок 7-8 суток у рачков получают 3 помета. При температуре 18oС сроки получения трех пометов у рачков могут растянуться до 28 суток. Численность молоди у рачков в первом помете невелика – по 2-6 особей, а начиная со второго помета – от 6 до 20 особей на самку. Этот вид цериодафний моно- или дицикличен. Максимум полового периода размножения приходится на август-сентябрь. В лабораторных условиях самцы появляются при недостаточном освещении, снижении температуры, концентрации растворенного кислорода, голодании. По отношению к кислородному фактору цериодафния довольно чувствительна, ее нормальное развитие протекает при концентрации растворенного кислорода в воде не ниже 5 мг Ο2/л. Вследствие этого цериодафнии чувствительны к органическому загрязнению веществами, снижающими концентрацию растворенного кислорода в среде.
Исследуя биологическое действие химических соединений, токсикологи регистрируют изменение выживаемости и плодовитости (основные показатели), длину тела цериодафний, используют биохимические и биофизические показатели; иногда встречаются данные об изменении морфологических признаков.
3.2.1. Методика проведения острого опыта на Ceriodaphnia affinis
В помещении, где содержатся цериодафнии, недопустима обработка химическими веществами с целью уничтожения насекомых, грызунов и др. Лабораторную культуру Ceriodaphnia affinis ведут на природной воде из водоема либо на водопроводной воде, отстоянной не менее семи суток и желательно дехлорированную путем аэрации. Вода должна удовлетворять следующим требованиям: 1) рН – 7,8-8,2; 2) общая жесткость – 1,3-2,0 мг-экв/л; 3) содержание растворенного кислорода – 5,0-7,0 мг О2/л. Рачков лучше всего культивировать в стаканах емкостью 0,5-1 литр, с плотностью посадки не более одной особи на 20 мл объема. При этом удается более объективно оценивать качество культуры, ее пригодность для токсикологических исследований, а также дает возможность вести клональные культуры. С целью адаптации рачков к условиям лаборатории их помещают в смешанную воду: 1 часть среды, в которой рачки жили ранее, и 3 части лабораторной воды. Культуральная среда обновляется полностью один раз в неделю. В качестве корма для цериодафний используют зеленые протококковые водоросли (Chlorella vulgaris) и пекарские дрожжи. Водоросли вносят в концентрации 250-500 тыс. кл/мл ежедневно (2 мл суспензии на 1 л воды). Дрожжи дают не чаще одного раза в неделю (1-2 мл 1%-ного раствора на 1 л), желательно перед сменой раствора. Культуру цериодафний выращивают в климатостате, люминостате или бюксе при оптимальных условиях содержания: температуре (25±1)oС, освещенности 400-600 лк, продолжительности светового дня 10-12 ч. При культивировании цериодафний удобно содержать рачков двух поколений – материнского (размножающиеся особи) и подрастающей молоди. Продолжительность использования маточных культур ограничивается 15-20 сутками. Отмечается каждое родившееся в лабораторных условиях поколение, и ставится дата рождения.
Для токсикологических исследований используют цериодафний, начиная с третьего поколения. Рачков в возрасте (4±2) ч исследуют на устойчивость к стандартному токсиканту – бихромату калия в остром опыте. Величина LC50 бихромата калия за 24 часа находится в интервале 1,0-2,2 мг/л. В дальнейшем эксперименты с бихроматом калия ставят одновременно с постановкой основного острого опыта с каждым веществом [54, 55, 57]. Перед основными острыми опытами проводят предварительные опыты для установления диапазона концентраций исследуемых веществ, которые вызывают иммобилизацию или гибель рачков в интервале 10-90 %. В предварительном остром опыте обычно используют по 5 концентраций для каждого вещества, различающихся в 10 раз: 100; 10; 1; 0,1; 0,01 мг/л. Длительность опыта 24 или 48 часов. Из концентраций, используемых в предварительных опытах, отбрасывают концентрации, которые вызывают гибель 0 или 100 % рачков. Оставшийся диапазон концентраций (в котором находится искомая летальная концентрация, вызывающая гибель 50 % рачков) используется для основного острого опыта. Продолжительность основного острого опыта для данного объекта исследования составляет 48 часов. Основным биологическим показателем служит выживаемость гидробионтов (процент гибели). Острый опыт проводится с набором из пяти концентраций исследуемого вещества, входящих в диапазон, установленный в предварительных испытаниях. Растворы веществ для опытов готовятся с учетом их растворимости. Для опытов используют химические стаканы объемом 250 мл, куда наливают по 50 мл раствора токсиканта и вносят от 5 до 10 рачков Ceriodaphnia affinis в возрасте (6±2) ч. Для статистической достоверности используют не менее трех повторностей для каждой концентрации. Параллельно ставят контрольные опыты с отстоянной водой и водой с растворителем, использовавшимся для растворения исследуемых веществ в концентрациях, соответствующих разведениям в опытах. Повторность контролей соответствует повторности в опытах. Если в контроле наблюдается значительная гибель организмов, опыт бракуется и должен быть повторен. Условия проведения опытов те же, что и при разведении культуры цериодафний, но в ходе острых опытов рачков не кормят, а смену раствора проводят ежедневно. Наблюдения за выживаемостью проводят непрерывно в течение первого часа воздействия раствора, через каждые 15 минут в продолжение второго часа, затем ежечасно до конца первого дня наблюдений, на следующий день – 2-3 раза в сутки[54, 55].
3.2.2. Обработка и оценка результатов эксперимента на Ceriodaphnia affinis
Для определения наличия острого действия растворов исследуемых веществ на цериодафний рассчитывают летальность (L, %) рачков для каждой концентрации и находят медиальную летальную концентрацию. Летальность (L, %) рассчитывается по формуле:
где XK – число выживших особей в контроле, шт.; Xо – число выживших особей в тестируемой воде, шт. В случае гибели дафний в контроле от 5 до 20 %, вносят поправку в результаты по формуле Аббота:
Результаты всех повторностей суммируются, и определяется средняя смертность организмов в данной концентрации токсиканта. По ней рассчитываются величины LC50 за 48 часов и определяются действующие концентрации веществ по наличию статистически достоверного снижения величины выживаемости цериодафний в опыте по сравнению с контролем. Достоверность полученных результатов считается надежной, если удовлетворены следующие условия: 1) гибель контрольных цериодафний не превышает 10 %; 2) LC50 бихромата калия за 24 часа для цериодафний в возрасте (6±2) часов находится в интервале 1,0-2,2 мг/л; 3) содержание растворенного кислорода в исследуемых растворах, определенное в конце опыта, не ниже 5,0 мг О2/л [54, 55, 57]. Медиальная летальная концентрация (LC50) определяется с помощью графического метода. Он основан на определении LC50 по кривой летальности или характеристической кривой, отражающей распределение индивидуальной устойчивости животных к исследуемому токсическому агенту. Характеристическая кривая строится путем нанесения концентраций или логарифмов концентраций по оси абсцисс, а процента летальности – по оси ординат. В полуграфическом виде эта зависимость близка к прямой. От точки на оси ординат, соответствующей 50 % смертности, проводится линия, параллельная оси абсцисс. Из точки пересечения этой линии с опытной прямой опускают перпендикуляр на ось абсцисс. Полученная концентрация разбавления Сх и будет соответствовать искомой величине LC50. Медиальную летальную концентрацию можно найти, решив уравнение, описывающее характеристическую кривую. Чем больше LC50, тем токсичнее тестируемое вещество. Зависимость между концентрацией и эффектом (в данном случае процентом гибели животных) при графическом изображении должна иметь вид S-образной кривой. При логарифмировании концентраций кривые становятся более симметричными [56].
3.3. Эксперимент на смешанной культуре Chlorella vulgaris и Scenedesmus quadricauda 3.3.1. Методика проведения острого опыта на смешанной культуре Chlorella vulgaris и Scenedesmus quadricauda
Методика основана на регистрации снижения темпов роста (снижение численности) клеток водорослей Chlorella vulgaris и Scenedesmus quadricauda под воздействием токсических веществ, присутствующих в тестируемой воде (опыт), по сравнению с контрольной культурой в пробах, не содержащих токсических веществ (контроль). Критерием острой токсичности является снижение численности клеток водорослей на 50 % и более, по сравнению с контролем в течение 96-часовой экспозиции. В экспериментах по определению острой токсичности устанавливают: 1) ингибирующую концентрацию, вызывающую снижение численности клеток водорослей на 50 % и более, по сравнению с контролем за 96 часов экспозиции; 2) безвредную концентрацию, вызывающую снижение численности клеток водорослей не более чем на 20 %, по сравнению с контролем за 96 часов экспозиции. Характеристики степени токсичности используемой воды приведены в таблице 13:
Таблица 13. Оценка токсичности воды.
Длительность эксперимента – 4 суток. Для эксперимента используются культуры, находящиеся в начальной фазе логарифмического роста (через 3-5 суток после перенесения в новую культуральную среду). Начальная плотность водорослей в контроле и опыте – в пределах 20-50 тыс. кл/мл. Опыты ставятся в трех повторностях. Для учета возможного эффекта растворителя на водоросли ставится второй контроль, в который добавляются эквивалентные количества растворителя. Общий объем жидкости в колбах составляет 40 мл, из них 12 мл – питательная среда Успенского №1 (KNO3 – 0,025 г/л, MgSO4 – 0,025 г/л, Ca(NO3)2 – 0,1 г/л, KH2PO4 – 0,025 г/л, K2CO3 – 0,0345 г/л); 8 мл – суспензия водорослей. Обязательное условие для постановки опыта – добавление питательной среды из такого расчета, чтобы через 4-5 суток численность водорослей возросла, по крайней мере, в 2 раза. Питательную среду стерилизуют в автоклаве (0,5 ч при 1 атм.) или сухим жаром (1 ч при 18oС), а при отсутствии автоклава – кипячением на медленном огне на водяной бане. Водоросли выращивают в стерильных колбах емкостью 0,25-0,5 л, закрытых ватно-марлевыми пробками, которые сверху прикрываются колпачками из стерильной пергаментной бумаги или полиэтиленовой пробкой. Для предотвращения оседания клеток на дно и их прикрепления к стенкам, а также для лучшего растворения углекислого газа, содержимое колб не менее двух раз в сутки перемешивают, избегая намокания пробок. Оптимальный режим предусматривает культивирование водорослей при температуре (20±2)oC в люминостате при естественном освещении и досвечивании в течение 12 часов в сутки лампами дневного света с общей освещенностью 3-5 тыс. лк. Повышение температуры до 25oС и выше усиливает действие токсиканта, поэтому культивировать водоросли и проводить опыты следует в термостатируемых установках. Колбы с водорослями размещают в люминостате так, чтобы освещение было равномерным снизу или сверху при удалении источника от колб на 30-40 см во избежание их перегрева. При отсутствии термостатируемых условий опыты могут проводиться с размещением колб на окне при естественном освещении, но с защитой от прямых солнечных лучей. Соответствующие наблюдения и анализы проводят ежедневно в течение четырех дней после постановки эксперимента. Оценивают число живых клеток в камере Горяева. При работе с ней просчитывают число клеток в 25 больших квадратах, а затем проводят пересчет на 1 см3 по формуле: х=m•104, где х – общее количество клеток в 1 см3; m – количество клеток в 25 больших квадратах. Для определения живых и мертвых клеток используют краситель – метиленовую синь и нейтральный красный. К 1 мл суспензии водорослей добавляют 1 мл метиленовой сини и нейтрального красного в разведении 1:5000. Растворы красителей и суспензии водорослей тщательно перемешивают и через 20 минут микроскопируют. При смешении двух красок мертвые клетки окрашиваются в фиолетовый цвет. Живые клетки имеют зеленую окраску.
3.3.2. Обработка и оценка результатов эксперимента на Chlorella vulgaris и Scenedesmus quadricauda
При определении острого токсического действия для каждой концентрации по результатам трех параллельных определений вычисляют среднее значение выживаемости по формуле:
где Х – среднее значение выживаемости, Хi – значение выживаемости в i -том параллельном определении, n – количество параллельных определений. Рассчитывают относительное (в %) изменение уровня численности клеток водорослей для каждой концентрации по сравнению с контролем (L):
где ХK – среднее значение выживаемости в контроле, Хo – среднее значение выживаемости в опыте.
Стимуляция (противоположная угнетению реакция тест-объектов на воздействие токсикантов) до уровня 30 %, по сравнению с контролем, считается как нетоксичное действие испытуемой воды на тест-объект. При стимуляции более 30 % вода признается токсичной, если в хроническом опыте на дафниях и цериодафниях выявляется увеличение плодовитости рачков более чем на 30 % в тестируемой воде, по сравнению с контролем [54].
|