Титрование по методу окисления-восстановления
Самоокисление-самовосстановление йода в растворе щёлочи
Наблюдается выпадение белого осадка и его растворение при взбалтывании смеси; при этом она окрашивается в бурый цвет.
Вывод:Анализ ОВР показывает, что в проведённых опытах окислителями являются хром, марганец, медь, кислород. Кроме того, йод является и окислителем, и восстановителем. Титрование по методу окисления-восстановления В отличие от методов нейтрализации и осаждения, где происходящая при титровании реакция заключается в соединении между собой каких-либо ионов с образованием недиссоциированных молекул слабого электролита (воды, слабых кислот) или осадка, в методе окисления-восстановления используются реакции, связанные с переходом электронов. В этих реакциях окислитель, присоединяя электроны, восстанавливается, а восстановитель, отдавая электроны, окисляется. Следствием такого перераспределения электронов является изменение валентности соответствующих атомов или ионов, причем валентность окисляющихся атомов или ионов повышается, а восстанавливающихся – понижается. Окислители и восстановители различаются между собой по силе, т.е. по химической активности. Так, сильные окислители обладают резко выраженным свойством присоединять к себе электроны. Поэтому они способны отнимать электроны у многих восстановителей, в том числе и у сравнительно слабых, т.е. отдающих свои электроны с трудом. Наоборот, у слабых окислителей способность присоединять электроны, выражена значительно слабее. Вследствие этого они могут окислять только более сильные (т.е. легко отдающие электроны) восстановители. О силе различных окислителей и восстановителей можно судить по величинам их окислительных потенциалов, происхождение которых обусловлено следующими процессами. Если электрод из благородного металла, например, платины, погрузить в раствор, содержащий окислитель или восстановитель, то некоторое количество электронов будет отнято у металла окислителем, или, наоборот, получено металлом от восстановителя. При этом электрод зарядится положительно или отрицательно до определенного потенциала, уравновешивающего стремление электронов к перераспределению. Чем более сильными окислительными свойствами обладает раствор, тем выше становится положительный заряд опущенного в него электрода. Потенциал, до которого заряжается электрод при погружении его в данный раствор и является мерой окислительной активности и называется окислительным потенциалом данного раствора. На практике окислители или восстановители всегда находятся в растворе вместе с продуктами их восстановления или окисления. Следовательно, следует говорить об окислительных потенциалах не отдельных окислителей или восстановителей, а об окислительно-восстановительных потенциалах окислительно-восстановительных пар (например, Fe+3/Fe+2). Во всякой окислительно-восстановительной паре различают окисленную форму, где данный элемент имеет большую валентность, и восстановленную форму, где его валентность меньше. При экспериментальном определении окислительных потенциалов различных пар следует учитывать, что их величина зависит не только от силы входящих в состав данной пары окислителя и восстановителя, но и отношения их концентраций. Для получения сравнимых результатов необходимо сделать эти концентрации одинаковыми. Измеряемые при этом окислительные потенциалы называются нормальными и обозначаются Ео. Для определения величины нормального окислительного потенциала какой-либо пары, например, Fe+3/Fe+2, ее комбинируют с нормальным водородным электродом в гальванический элемент. Катодом этого элемента является нормальный водородный электрод, а роль анода выполняет электрод из платины, погруженный в смесь равных объемов растворов FeCl3 и FeCl2, одинаковых молярных концентраций. На катоде гальванического элемента происходит процесс отдачи электронов молекулами Н2 платиновому электроду, т.е. реакция их окисления в ионы Н+ согласно уравнению:
Н2 – 2е = 2Н+
Освобождающиеся при этом электроны перетекают по проводнику к аноду, где их присоединяют ионы Fe+3, восстанавливающиеся при этом в ионы Fe+2: 2Fe+3 + 2e = 2Fe+2
Сложив почленно оба уравнения, получим общее уравнение реакции, происходящей при работе данного элемента:
2Fe+3 + H2 = 2Fe+2 + 2H+
Измеренная величина электродвижущей силы элемента оказалась равной 0.77 В. Поскольку, при заданных условиях, она представляет собой разность нормальных окислительных потенциалов обеих пар, можно записать:
Величина
Знак «+» показывает, что данная пара при комбинации ее с нормальным водородным электродом играет роль положительного полюса. Наоборот, если пара является отрицательным полюсом (т.е. при работе элемента отдает электроны ионам Н+, восстанавливая их в Н2), то потенциал ее считается отрицательным. Полученная для пары Fe+3/Fe+2 величина нормального окислительного потенциала (+ 0.77 В) является мерой способности ионов Fe+3 отнимать электроны от молекул Н2, т.е. окислять их в ионы Н+. Если вместо пары Fe+3/Fe+2 скомбинировать нормальный водородный электрод с парой Cl2/2Cl-, величина нормального окислительного потенциала пары Cl2/2Cl- оказывается значительно большей, чем пары Fe+3/Fe+2, и равной +1.36 В. Следовательно, стремление к присоединению электронов (т.е. окислительная активность) у свободного хлора значительно больше, чем у ионов Fe+3. В соответствии с этим, ионы Cl- являются более слабым восстановителем, чем ионы Fe+2. Таким образом, чем больше величина нормального окислительного потенциала данной пары, тем более сильным окислителем является ее окисленная форма и тем более слабым восстановителем – восстановленная форма. Когда комбинируются две какие-либо окислительно-восстановительные пары, то более сильный из двух окислителей отнимает электроны у более сильного восстановителя, причем образуются более слабые восстановитель и окислитель. В соответствии с этим можно сформулировать правило: окислители с большим потенциалом способны окислять любой восстановитель с меньшим потенциалом. Точно также восстановители с меньшим потенциалом способны восстанавливать окислители с большим потенциалом. Исходя из этого, пользуясь таблицей величин нормальных окислительных потенциалов, можно предвидеть направление течения различных окислительно-восстановительных реакций, выбирать подходящие окислители и восстановители и решать важные для аналитической практики вопросы. Так, например, сильнейшим из всех окислителей является свободный фтор, которому соответствует наибольшая величина нормального окислительного потенциала Ео = + 2.85 В. К числу весьма сильных окислителей принадлежат также перманганат-ионы в кислой среде (Ео = + 1.51 В), бихромат-ионы в кислой среде (Ео= + 1.36 В), свободный бром (Ео = + 1.07 В). При решении аналитических задач с использованием окислительно-восстановительных реакций следует обязательно учитывать влияние на величину окислительного потенциала концентраций каждого из компонентов и реакцию среды. Зависимость между величиной окислительно-восстановительного потенциала какой либо данной пары и концентрациями соответствующих окисленной [ок.] и восстановленной [вос.] форм выражается уравнением Нернста:
Если подставить численные значения констант и от натуральных логарифмов перейти к десятичным, то для комнатной температуры (18оС) получим:
Так, для пары Fe+3/Fe+2 при концентрациях ионов: [Fe+3]=1 г-ион/л и [Fe+2]=0.0001 г-ион/л величина окислительно-восстановительного потенциала определяется соотношением:
В тех случаях, когда в уравнении реакции, происходящей при превращении окисленной формы в восстановленную, имеются стехиометрические коэффициенты, не равные единице, они входят в уравнение Нернста в качестве показателей степени для концентраций соответствующих ионов. Например, для пары Br2/2Br- будет справедливо следующее уравнение:
В случае пар, подобных Zn+2/Zn, где один из компонентов представляет собой практически нерастворимое в воде вещество (Zn), его концентрация принимается величиной постоянной и по этой причине в выражение для расчета окислительно-восстановительного потенциала не входит:
В случае анионов кислородсодержащих кислот часто превращение окисленной формы в восстановленную, сопровождается глубоким изменением их состава и происходит при участии ионов водорода. Например, при реакциях окисления, проводимых бихроматом в кислой среде, анион Cr2O7-2 восстанавливается по уравнению:
В таких случаях величина окислительно-восстановительного потенциала зависит также и от концентрации ионов водорода в растворе, которая входит в уравнение Нернста в степени, равной соответствующему стехиометрическому коэффициенту:
Видно, что концентрация ионов водорода сильно влияет на величину окислительно-восстановительного потенциала раствора, а, следовательно, и на его окислительную активность. В этой связи следует учитывать возможность изменения направления окислительно-восстановительного процесса, обусловленное изменением рН среды. Далее, если концентрации отдельных компонентов каких-либо окислительно-восстановительных пар изменять, то будут меняться и величины их окислительно-восстановительных потенциалов. При этом может случиться, что та из пар, у которой нормальный окислительно-восстановительный потенциал больше, получит в результате такого изменения меньший потенциал, чем другая пара. Следовательно, и направление реакции между такими парами станет обратным тому, какое вытекает из их положения в таблице нормальных окислительных потенциалов.
При проведении титриметрических определений по методу окислительно-восстановительного титрования концентрации участвующих в реакции веществ или ионов, по мере прибавления новых объемов титранта, будут изменяться. Следовательно, будет изменяться и величина окислительно-восстановительного потенциала системы. Так, при хроматометрическом определении Fe+2, уравнение происходящей при титровании реакции следующее:
Поскольку реакция обратима, при титровании в растворе все время присутствуют как исходные, так и образовавшиеся при реакции ионы. Следовательно, в любой момент титрования раствор всегда содержит две окислительно-восстановительные пары: Fe+3/Fe+2 и Cr2O7-2/Cr+3. Таким образом, для вычисления величины окислительно-восстановительного потенциала системы имеются два уравнения:
В начале процесса титрования, пока еще не оттитрованы все ионы Fe+2, концентрации ионов Fe+2 и Fe+3 можно легко вычислить для любого момента титрования. Концентрацию оставшихся непревращенными (вследствие обратимости реакции) ионов Cr2O7-2 вычислить гораздо сложнее. Поэтому для расчета потенциала системы до точки эквивалентности целесообразно пользоваться уравнением (1). После точки эквивалентности, при избытке раствора титранта легко вычисляются концентрации ионов Cr2O7-2 и Cr+3 и гораздо труднее концентрация оставшихся непревращенными ионов Fe+2. В этой связи, для расчета потенциала системы после точки эквивалентности целесообразно использовать уравнение (2). В точке эквивалентности величина потенциала системы, рассчитанная по уравнениям (1) и (2), принимает одно и то же численное значение и может быть рассчитано из системы этих уравнений с учетом того обстоятельства, что в точке эквивалентности имеет место строго определенное уравнением реакции соотношение концентраций реагирующих ионов в растворе. В соответствии с отмеченным, если нормальные потенциалы пар, соответствующие взятым окислителю и восстановителю, равны
Для рассматриваемого процесса хроматометрического определения Fe+2 численное значение величины потенциала в точке эквивалентности оказывается равным 1.275 В:
Характер изменения численных значений окислительно-восстановительного потенциала раствора по мере прибавления титранта имеет такой же вид, как и кривые титрования по методу нейтрализации. Именно, вблизи точки эквивалентности здесь также наблюдается резкий скачок потенциала, в то время как на других участках кривая идет полого, т.е. величина окислительно-восстановительного потенциала изменяется очень медленно. Наличием скачка на кривой титрования можно воспользоваться для точного фиксирования точки эквивалентности либо с помощью особых индикаторов, либо путем измерения величины потенциала раствора в процессе титрования, построения по полученным значениям кривой титрования и нахождения на ней точки эквивалентности. Отмеченная возможность и реализуется в методе окислительно-восстановительного потенциометрического титрования. Характерно, что величина скачка потенциала зависит от разности нормальных потенциалов обеих пар: чем больше эта разность, тем больше и указанный скачок. В то же время численные значения потенциалов не зависят от разбавления раствора, поскольку в уравнение Нернста входит отношение концентраций окисленной и восстановленной форм, которое с разбавлением раствора не изменяется. Другое достоинство метода заключается в том, что область скачка на кривой титрования можно значительно расширить, если один из образующихся при реакции ионов связывать в комплекс. В аналитической практике метод окислительно-восстановительного потенциометрического титрования основан на измерении разности потенциалов между индикаторным электродом, изготовленным из трудно окисляемых металлов (с высоким значением нормального окислительно-восстановительного потенциала EоMe
Практическая часть
Задача № 1. Выбор оптимальных условий анализа. Экспериментальное установление потенциала точки эквивалентности. Титрование в автоматическом режиме.
1 этап. С целью выбора оптимальных условий анализа необходимо установить влияние концентрации серной кислоты в анализируемом растворе на величину скачка титрования. Для этого в стаканчик для титрования внести известное количество стандартного раствора Fe+2 (раствор получить у лаборанта), довести его объем до 50 мл дистиллированной водой и тщательно перемешать на магнитной мешалке. Заполнить бюретку для титрования рабочим раствором бихромата калия (бюретка оборудована двухходовым краном). Подготовить иономер ЭВ-74 к работе. Выполнить предварительное титрование анализируемой пробы, прибавляя раствор титранта объемами по 0.5 мл. Построить кривую титрования и установить ориентировочную величину диапазона скачка потенциала и ориентировочное значение потенциала в точке эквивалентности. Повторить титрование точно таких же проб в режиме точного титрования, прибавляя раствор титранта в предварительно установленном диапазоне скачка потенциала объемами по 0.1 мл. Построить кривую титрования, установить точное положение точки эквивалентности и установить точное значение диапазона скачка потенциала при титровании анализируемой пробы в отсутствие в титруемом растворе серной кислоты. Выполнить предварительное, а затем и точное титрование новой пробы, добавив в стаканчик для титрования 5 мл раствора серной кислоты (концентрации 1:1). Построить кривую титрования и установить точное значение диапазона скачка потенциала при титровании анализируемой пробы в присутствие в титруемом растворе данного количества серной кислоты. Затем построить кривые титрования новых проб, последовательно увеличивая содержание серной кислоты в титруемом растворе (10, 15, 20 мл). Установить характер зависимости величины скачка потенциала при титровании от содержания серной кислоты в титруемом растворе и выбрать оптимальные условия титрования. Для этих условий установить точное значение потенциала точки эквивалентности. Установленное значение потенциала точки эквивалентности может отличаться от теоретически рассчитанного.
2 этап. Настройка блока автоматического титрования БАТ-15 для выполнения процесса титрования до заданного значения потенциала, соответствующего потенциалу в точке эквивалентности. Подключить БАТ-15 к сети переменного тока (220 В). На панели управления БАТ-15 перевести утопленное положение кнопки «сеть» и «включено». Прогреть прибор в течение 15-20 минут. Для установки найденного значения потенциала точки эквивалентности на панели управления БАТ-15 утопить кнопку «1-узкий» и потенциометром на шкале «заданная точка» установить значение потенциала, после прибавления к которому 400 мВ, получается величина на 10-20 мВ меньшая, чем потенциал точки эквивалентности. В стаканчик для титрования поместить известное количество раствора Fe+2, добавить установленное ранее количество серной кислоты (для обеспечения максимального скачка потенциала), дистиллированной воды и тщательно перемешать на магнитной мешалке. Опустить в стаканчик электроды и дозирующую титрант трубку. Открыть на бюретке кран подачи титранта. На панели управления БАТ-15 потенциометр «выдержка» установить в положение 35, а потенциометр «зона» в положение 4. Путем нажатия кнопок «вкл» и «пуск» начать процесс титрования в автоматическим режиме. Начало подачи титранта сопровождается сигналом лампочки «процесс». По достижении потенциала точки эквивалентности магнитный клапан блокирует дальнейшую подачу титранта из бюретки. О завершении процесса автоматического титрования сигнализирует лампочка «конец». Определить объем титранта пошедшего на титрование и сопоставить его с теоретически рассчитанным. Сопоставить также регистрируемое потенциометром ЭВ-74 численное значение потенциала точки эквивалентности с ранее заданным. В случае недопустимых расхождений величин потенциалов выполнить мероприятия по дополнительной настройке блока автоматического титрования путем изменения численного значения задаваемого потенциала до совпадения объемов титранта до точки эквивалентности при ручном и автоматическом титровании.
Задача № 2. Анализ металла или сплава на содержание железа Точную навеску исследуемого образца (0.1 г) растворить в минимальном объеме серной кислоты (1:1). Используя клапан Бунзена, с помощью металлического цинка осуществить реакцию восстановления Fe+3 до Fe+2. Полученный раствор количественно перенести в мерную колбу объемом 100 мл и довести до метки дистиллированной водой. В стаканчик для титрования отобрать 10 мл раствора исследуемого образца, добавить требуемое количество серной кислоты (1:1) и довести объем раствора в стаканчике до 50 мл дистиллированной водой. Выполнить несколько точных титрований в ручном и автоматическом режиме. Рассчитать процентное содержание железа в сплаве и выполнить статистическую обработку полученных результатов.
Потенциометрическое титрование по методу осаждения Метод осаждения основан на применении при титровании реакций, сопровождающихся образованием каких-либо трудно растворимых соединений. При этом предпочтение следует отдавать реакциям, отвечающим следующим условиям: - образующийся осадок должен быть практически нерастворим - выпадение осадка должно происходить достаточно быстро (т.е. не должно сказываться явление образования пересыщенных растворов) - результаты титрования не должны в заметной степени искажаться явлениями адсорбции (соосаждения) - должна существовать возможность фиксировать точку эквивалентности при титровании. Отмеченные требования сильно ограничивают круг реакций, практически используемых в титриметрическом анализе. Наиболее важное значение имеют методы, основанные на реакциях осаждения трудно растворимых солей серебра, протекающих по уравнению:
где через Х- обозначены анионы, дающие осадки с катионом Ag+. Для установления точки эквивалентности при титровании рабочим раствором азотнокислого серебра используются различные методы: - безиндикаторный метод (Гей-Люссака) - с применением индикаторов (метод Мора, метод Фольгарда) - метод потенциометрической индикации точки эквивалентности. Потенциометрическое титрование по методу осаждения основано на измерении величины разности потенциалов между индикаторным электродом и электродом сравнения в любой момент титрования, построения кривой титрования и установления из нее объема титранта, затраченного до точки эквивалентности. В качестве индикаторных электродов используется металлические электроды второго рода, численное значение потенциала которых определяется концентрацией аниона, способного образовывать трудно растворимое соединение с ионами металла электрода. Величина потенциала серебряного электрода, покрытого слоем осадка хлорида серебра, определяется соотношением:
и зависит от концентрации хлорид-иона в анализируемом растворе. В качестве электродов сравнения чаще всего используются вторичные электроды сравнения, изготовленные на основе металлических электродов второго рода. При этом особое внимание следует обращать на состав внутреннего раствора электрода сравнения: он не должен содержать определяемые анионы. Именно по этой причине, при использовании хлорсеребряного электрода сравнения в качестве внутреннего раствора вместо насыщенного раствора хлорида калия используется 1М раствор сульфата аммония.
Потенциометрическое определение галогенид-ионов при совместном присутствии
Поскольку величины произведения растворимости трудно растворимых соединений различных галогенид-ионов с катионом серебра существенно различаются, существует возможность количественного определения каждого из галогенидов при их совместном присутствии в анализируемом растворе.
|


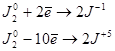

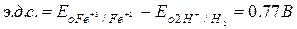
 условно принята за нуль. Следовательно
условно принята за нуль. Следовательно
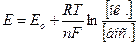
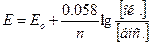
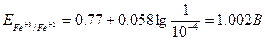
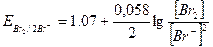
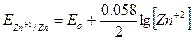
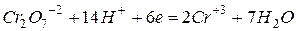
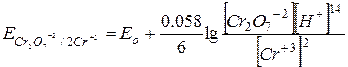

 (1)
(1) (2)
(2) и
и 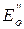 , а стехиометрические коэффициенты при них а и b, то величина окислительно-восстановительного потенциала раствора в точке эквивалентности определяется по соотношению:
, а стехиометрические коэффициенты при них а и b, то величина окислительно-восстановительного потенциала раствора в точке эквивалентности определяется по соотношению: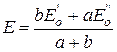

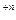 /Me, как, например, у платины, золота и др.), непосредственно не участвующих в электрохимических реакциях, а являющихся лишь передатчиками электронов и электродом сравнения, погруженными в раствор, в котором протекает реакция окисления-восстановления.
/Me, как, например, у платины, золота и др.), непосредственно не участвующих в электрохимических реакциях, а являющихся лишь передатчиками электронов и электродом сравнения, погруженными в раствор, в котором протекает реакция окисления-восстановления.




