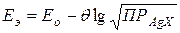Поскольку величина произведения растворимости иодида серебра
ПРAgI = 8.3 10-17 значительно меньше величины произведения растворимости хлорида серебра ПРAgCl = 1.8 10-10, прибавление в анализируемый раствор, содержащий эти анионы, первыми начинают осаждаться иодид-ионы. Переход только иодид-ионов в осадок будет происходить до тех пор, пока концентрация прибавляемых катионов серебра в анализируемом растворе не станет достаточной для осаждения хлорид ионов. Величина этой концентрации рассчитывается из величины произведения растворимости:
С другой стороны, концентрация ионов серебра в растворе над осадком иодида серебра определяется соотношением:
В момент завершения процесса осаждения иодид-иона и начала процесса осаждения хлорид-иона, величина концентрации ионов серебра в анализируемом растворе должна удовлетворять каждому из приведенных уравнений. В соответствии с отмеченным, будет справедливо уравнение:
Последнее уравнение позволяет рассчитать соотношение концентраций хлорид- и иодид-ионов в растворе, при котором начинается их совместное осаждение:
Таким образом, если в анализируемом растворе исходная концентрация хлорид-ионов составляет 0.01 г-ион/л, то процесс совместного осаждения хлорид- и иодид-ионов начнется только тогда, когда концентрация иодид-ионов составит величину:
Поскольку соединение считается практически полностью переведенным в осадок, если его концентрация в растворе над осадком меньше величины 10-6 моль/л, в момент начала осаждения хлорид-иона, иодид-ионы анализируемого раствора находятся в осадке. Величина потенциала индикаторного электрода, а следовательно и измеряемая величина разности потенциалов индикаторного электрода и электрода сравнения, в процессе титрования иодид-иона определяется только величиной концентрации иодид-иона в растворе до полного его перевода в осадок. Затем величина потенциала индикаторного электрода, а следовательно и измеряемая величина разности потенциалов индикаторного электрода и электрода сравнения, будут определяется уже только величиной концентрации хлорид-иона в растворе. Таким образом, на кривой потенциометрического титрования регистрируются два скачка, первый из которых соответствует процессу титрования иодид-иона, а второй – процессу титрования хлорид иона. При выполнении титрования следует учитывать следующее. В начале процесса титрования иодид-ионов численное значение величины потенциала электрода сравнения оказывается больше, чем величина потенциала индикаторного электрода. В этой связи измеряемая разность величин потенциалов индикаторного электрода и электрода сравнения оказывается в области отрицательных значений. В ходе дальнейшего титрования иодид-ионов, а также в ходе процесса титрования хлорид-ионов, измеряемая разность потенциалов принимает положительные значения. В этой связи следует своевременно произвести операцию переключения потенциометра в соответствующий режим измерения.
Определение величины произведения растворимости трудно растворимых соединений по результатам потенциометрического титрования
В точке эквивалентности при титровании галогенид-иона катионом серебра анализируемый раствор будет содержать осадок состава AgX в равновесии с насыщенным раствором этого же соединения. При этом равновесные концентрации галогенид-иона и иона серебра будут равны между собой и определяются величиной произведения растворимости:
Величина измеряемого в точке эквивалентности потенциала системы рассчитывается из соотношения:
где Последнее уравнение позволяет рассчитать величину произведения растворимости трудно растворимого соединения AgX в используемом растворителе, если известны величины потенциала системы в точке эквивалентности Еэ, стандартный потенциал Ео и наклон электродной функции Для установления величины наклона электродной функции следует выбрать на кривой потенциометрического титрования две точки, находящиеся на кривой до точки эквивалентности и характеризующиеся величинами потенциалов Е1 и Е2, численные значения которых различаются не менее, чем на 30 мВ. Величины потенциалов системы в этих точках определяются соотношениями:
где Тогда из соотношения:
можно рассчитать численное значение величины наклона электродной функции И, наконец, используя соотношение:
рассчитывается величина произведения растворимости соединения AgX в используемом растворителе.
|






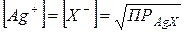
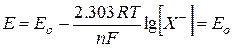 -
-  =Eo -
=Eo -  lg[ПРAgX]
lg[ПРAgX] и
и 
 и
и  - концентрации галогенид-иона в выбранных точках 1 и 2, численные значения которых рассчитываются по правилу эквивалентов.
- концентрации галогенид-иона в выбранных точках 1 и 2, численные значения которых рассчитываются по правилу эквивалентов.