КАМФОРА
(камфара; 2-борнанон; 1,7,7-триметилбицикло[2.2.2]гептан-2-он)
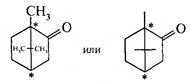
Камфора является бициклическим кетоном на основе камфана (борнана). В структуре молекулы содержится 2 асимметрических атома, но вместо четырех ожидаемых изомеров камфора существует только в виде двух изомеров. Отсутствие диастереомеров объясняется тем, что асимметрические атомы жестко связаны между собой тремя углеродными цепями, что исключает возможность иной конфигурации. Получение камфоры 1. Из природных источников. D-камфору получают из 60-100-летних деревьев камфорного дерева, которое произрастает во Вьетнаме, Китае, Японии, Тайване, а также культивируется в тропиках. Камфора содержится в эфирных маслах камфорного лавра, сибирской пихты, базилика, полыни, камфорного шалфея. Природные источники не удовлетворяют потребности в камфоре, поэтому используются полусинтетические и синтетические способы получения. 2. Получение из борнилацетата (метод Н.В. Вершинина). Этот метод получения камфоры из пихтового масла, содержащего 30—40% борнилацетата, имеет промышленное значение. Борнилацетат отделяют, подвергают омылению, и полученный (—)-борнеол окисляют хромовой смесью в (—)-камфору. 3. Получение рацемической камфоры из α-пинена (синтез В.Е. Тищенко):
Камфора — бесцветное кристаллическое вещество (tпл 178 °С) с резким характерным запахом, флуоресцирует в УФ-свете, растворима в спирте, малорастворима в воде. Вращение и хаотическое движение кристаллов по поверхности воды связано с тем, что камфора летуча (легко сублимируется). Упругость ее паров на разных поверхностях кристалла неодинакова, вследствие этого кристалл с разными гранями с различной силой отталкивается от поверхности пленки воды, что и вызывает его вращение. Химические свойства камфоры Камфора — типичный кетон. С участием оксогруппы она образует оксимы, семикарбазоны, фенилгидразоны.
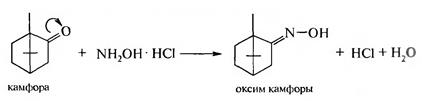
1. Взаимодействие с гидроксиламина гидрохлоридом:
Реакция применяется для количественного определения камфоры по выделяемому эквивалентному количеству HCI. 2. Окисление и восстановление камфоры:
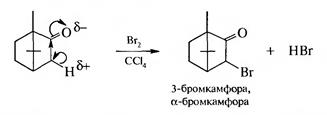
3. Взаимодействие с бромом. Карбонильная группа активирует атомы водорода в α-положении, метиленовая группа проявляет С—Н-кислотный характер, в результате чего возможно замещение на галоген:
В медицине камфору используют как кардиотоническое, аналеп- тическое, местнораздражающее и антисептическое средство, в промышленности — как пластификатор, компонент бездымного пороха, репеллент. Бромкамфору применяют при заболеваниях центральной нервной системы как успокаивающее средство.
|