Смещение химического равновесия
Химическое равновесие сохраняется до тех пор, пока остаются неизменными условия, в которых система находится. Изменение условий (концентрация веществ, температура, давление) вызывает нарушение равновесия. Через некоторое время химическое равновесие восстанавливается, но уже в новых, отличных от предыдущих условиях. Такой переход системы из одного равновесного состояния в другое называется смещением (сдвигом) равновесия. Направление смещения подчиняется принципу Ле Шателье. При увеличении концентрации одного из исходных веществ равновесие смещается в сторону большего расхода этого вещества, усиливается прямая реакция. Уменьшение концентрации исходных веществ смещает равновесие в сторону образования этих веществ, так как усиливается обратная реакция. Повышение температуры смещает равновесие в сторону эндотермической реакции, при понижении температуры – в сторону экзотермической реакции. Увеличение давления смещает равновесие в сторону уменьшения количеств газообразных веществ, то есть в сторону меньших объемов, занимаемых этими газами. Напротив, при понижении давления равновесие смещается в сторону возрастания количеств газообразных веществ, то есть в сторону больших объемов, образуемых газами. П р и м е р 1. Как повлияет увеличение давления на равновесное состояние следующих обратимых газовых реакций: а) SO2 + C12=SO2CI2; б) Н2 + Вr2=2НВr. Решение: Используем принцип Ле Шателье, согласно которому повышение давления в первом случае (а) смещает равновесие вправо, в сторону меньшего количества газообразных веществ, занимающих меньший объем, что ослабляет внешнее воздействие возросшего давления. Во второй реакции (б) количество газообразных веществ, как исходных, так и продуктов реакции, равны, как равны и занимаемые ими объемы, поэтому давление не оказывает влияния и равновесие не нарушается. П р и м е р 2. В реакции синтеза аммиака (–Q) 3Н2 + N2 = 2NН3 + Q прямая реакция экзотермическая, обратная – эндотермическая. Как следует изменить концентрацию реагирующих веществ, температуру и давление для увеличения выхода аммиака? Решение: Для смещения равновесия вправо необходимо: а) увеличить концентрации Н2 и N2; б) понизить концентрацию (удаление из сферы реакции) NH3; в) понизить температуру; г) увеличить давление. П р и м е р 3. Гомогенная реакция взаимодействия хлороводорода и кислорода обратима: 4НС1 + O2 = 2С12 + 2Н2O + 116 кДж. 1. Какое влияние на равновесие системы окажут: а) увеличение давления; б) повышение температуры; в) введение катализатора? Решение: а) В соответствии с принципом Ле Шателье повышение давления приводит к смещению равновесия в сторону прямой реакции. б) Повышение t° приводит к смещению равновесия в сторону обратной реакции. в) Введение катализатора не смещает равновесия. 2. В каком направлении сместится химическое равновесие, если концентрацию реагирующих веществ увеличить в 2 раза? Решение: Начальные скорости прямой и обратной реакций следующие: υ→ = k→[HCl]02[O2]02; υ0← = k←[H2O]02[Cl2]02 После увеличения концентраций скорость прямой реакции стала: υ→ = k→[2HCl]4[2O2] = 32 k→[HCl]04[O2]0 то есть возросла по сравнению с начальной скоростью в 32 раза. Аналогичным образом скорость обратной реакции возрастает в 16 раз: υ← = k←[2H2O]2[2Cl2]2 = 16k←[Н2O]02[С12]02. Увеличение скорости прямой реакции в 2 раза превышает увеличение скорости обратной реакции: равновесие смещается вправо. П р и м е р 4. Вкакую сторону сместится равновесие гомогенной реакции: PCl5 = РС13 + Сl2 + 92 КДж, если повысить температуру на 30 °С, зная, что температурный коэффициент прямой реакции равен 2,5, а обратной – 3,2? Решение: Поскольку температурные коэффициенты прямой и обратной реакций не равны, повышение температуры по-разному скажется на изменении скоростей этих реакций. Пользуясь правилом Вант-Гоффа (1.3), находим скорости прямой и обратной реакций при повышении температуры на 30 °С: υ→(t2) = υ→(t1) υ←(t2) = υ← (t1) Повышение температуры увеличило скорость прямой реакции в 15,6 раза, обратной – в 32,8 раза. Следовательно, равновесие сместится влево, в сторону образования РСl5. П р и м е р 5. Как изменятся скорости прямой и обратной реакций в изолированной системе С2Н4 + H2 ⇄ С2Н6 и куда сместится равновесие при увеличении объема системы в 3 раза? Решение: Начальные скорости прямой и обратной реакций следующие: υ0 = k[C2H4]0 [H2]0; υ 0 = k[C2H6]0. Увеличение объема системы вызывает уменьшение концентраций реагирующих веществ в 3раза, отсюда изменение скорости прямой и обратной реакций будет следующим: υ 0 = k[1/3 С2Н4] [1/3Н2] = 1/9υ0 υ = k[1/3C2H5] = 1/3υ0 Понижение скоростей прямой и обратной реакций неодинаково: скорость обратной реакции в 3 раза (1/3: 1/9 = 3) превышает скорость обратной реакции, поэтому равновесие сместится влево, в сторону, где система занимает больший объем, то есть в сторону образования С2Н4 и Н2.
Основная литература Ерохин Ю. М. Химия (СПО), 15-е издание. М.: «Академия», 2010 Ахмедова Т. И., Мосягина О.В. Естествознание. Учебное пособие. М.: РАП, 2012 Ахмедова Т. И., Мосягина О.В. Естествознание. CD. М.: РАП, 2013 Глинка Н. А. Общая химия. Ленинград: Химия, 1988. Дополнительная литература Ахмедова Т. И. Химия. Теоретические основы курса. Учебное пособие. М.: РАП, 2006 Габриелян О. С., Остроумов И. Г. Химия (СПО), 7-е издание. М.: «Академия», 2011 Габриелян О. С., Остроумов И. Г. Химия (для профессий и специальностей социально-экономического и гуманитарного профилей. М.: «Академия», 2010 Кузнецова Н.Е., Гара Н.Н. Химия 10. М.: ВЕНТАНА-ГРАФ, 2008 Кузнецова Н.Е., Гара Н.Н. Химия 11. М.: ВЕНТАНА-ГРАФ, 2008 Рудзитис Г. Е., Фельдман Ф. Г. Химия. Учебник для 10 класса общеобразоват. учрежд. М.: Просвещение, 2010 Рудзитис Г. Е., Фельдман Ф. Г. Химия. Учебник для 11 класса общеобразоват. учрежд. М.: Просвещение, 2010 Степин, Б. Д., Аликберова, Л. Ю. Книга по химии для домашнего чтения. Научно-популуярная литература. – М.: Химия, 1994. Браун, Т., Лемей, Г. Химия в центре наук. – М.: Мир, 1985. Бабич, Л. В., Балезин, С. А., Гликина, Ф. Б. и др. Практикум по неорганической химии. – М.: Просвещение, 1978. Дьякович, С. В. Методика факультативных занятий по химии. – М.: Просвещение, 1985. Кузьменко, Н. Е., Еремин В. В. Химия. Пособие для средней школы 8–11 классы. – М.: Экзамен. Оникс 21 век, 2001. Мильчев, В. А., Ковалева З. С. Типовые расчетные задачи по химии для учащихся 9 классов на базе учебного стандарта. – М.: Аркти, 2002. Хомченко, Г. П., Хомченко, И. Г. Сборник задач по химии для поступающих в вузы. – М.: Новая волна, 1996. Интернет – источники http://www.polnaja-jenciklopedija.ru/nauka-i-technika/chimicheskie-reaktsii.html http://prosto-o-slognom.ru/chimia/18_chim_reak.html http://www.yaklass.ru/materiali?mode=lsntheme&themeid=147 https://ru.wikipedia.org/wiki/%D0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%80%D0%B5%D0%B0%D0%BA%D1%86%D0%B8%D1%8F http://www.xumuk.ru/ http://www.alhimikov.net/elektronbuch/Page-13.html
|

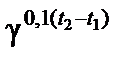 = υ→(t1)2,50,1·30 = 15,6υ→(t1);
= υ→(t1)2,50,1·30 = 15,6υ→(t1);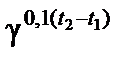 = υ→(t1)3,20,1·30 = 32,8υ← (t1)
= υ→(t1)3,20,1·30 = 32,8υ← (t1)


