А). Сожжены с образованием H2O (г) равные объемы водорода и ацетилена, взятые при одинаковых условиях. В каком случае выделится больше теплоты? Во сколько раз? (Ответ: 5,2).
б). Исходя из стандартных энтальпий образования и стандартных энтропий соответствующих веществ, вычислить ∆ G° х.р. для реакции, протекающей по уравнению Н2 (г) + СО2 (г) = СО (г) + Н2О (ж). Может ли эта реакция при стандартных условиях идти самопроизвольно? (Ответ: 20 кДж). 3.4. а). Вычислить, сколько теплоты выделится при сгорании 165 л ацетилена при нормальных условиях, если продуктами сгорания являются диоксид углерода и пары воды. (Ответ: 9248,8 кДж). б). Возможна ли при стандартных условиях реакция 4Al (к) + 3CO2 (г) = 2Al2O3 (к) + 3C (к)? Ответ обосновать, вычислив ∆ G° х.р.. 3.5. а). Газообразный этиловый спирт С2H5OH можно получить при взаимодействии этилена С2Н4 (г) и водяных паров. Вычислить тепловой эффект этой реакции и написать термохимическое уравнение. Сколько теплоты выделится, если в реакции было израсходовано 100 л этилена при нормальных условиях? (Ответ: –45,8 кДж; 204,5 кДж). б). Вычислить изменение энтропии реакции, протекающей по уравнению С2Н4 (г) + 3О2 (г) = 2СО2 (г) + 2Н2О (г). (Ответ: −29,6 Дж/К). 3.6. а). Вычислить, какое количество теплоты выделилось при восстановлении Fe2O3 металлическим алюминием, если было получено 335,1 г железа. (Ответ: 2554,5 кДж). б). Рассчитать ∆ G° реакции, протекающей по уравнению N2 (г) + 2H2O (ж) = NH4NO2 (к), и сделать вывод о возможности ее протекания. (Ответ: 590,5 кДж). 3.7. а). При растворении 16 г СаС2 в воде выделяется 31,27 кДж теплоты. Определить стандартную энтальпию образования Са(ОН)2. (Ответ: –986,2 кДж/моль). б). Вычислить D S ° следующих реакций: С (графит) + СО2 (г) = 2СО (г); С (графит) + О2 (г) = СО2 (г). (Ответ: 175,6 Дж/К; 3 Дж/К). 3.8. а). При восстановлении 12,7 г оксида меди (II) углем (с образованием СО) поглощается 8,24 кДж. Определить стандартную энтальпию образования СuO. (Ответ: –162 кДж/моль). б). Вычислить, при какой температуре наступит равновесие системы СО (г) + 2Н2 (г) ↔ СН3ОН (ж). (Ответ: 386 К). 3.9. а). Вычислить тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений: FeO (к) + CO (г) = Fe (к) + СO2 (г), ∆ Н° = –19,2 кДж; СO (г) + ½O2 (г) = СO2 (г), ∆ Н° = –283 кДж; H2 (г) + ½O2 (г) = H2O (г), ∆ Н° = –241,8 кДж. (Ответ: 22 кДж). б). Реакция горения ацетилена идет по уравнению С2Н2 (г) + 5½О2 (г) = 2СО2 (г) + Н2О (ж). Вычислить ∆ G° х.р. и ∆ S° х.р.Объяснить уменьшение энтропии в результате этой реакции. (Ответ: −1235,3 кДж; −215,8 Дж/К). 3.10. а). Вычислить стандартную энтальпию образования NO из простых веществ, исходя из следующих термохимических уравнений: 4NH3 (г) + 5О2 (г) = 4NO (г) + 6Н2О (ж), ∆ Н °= –1168,80 кДж; 4NH3 (г) + 3О2 (г) = 2N2 (г) + 6Н2О (ж), ∆ Н ° = –1530,28 кДж. (Ответ: 90,37 кДж). б). При какой температуре наступит равновесие системы СН4 (г) + СО2 (г) = 2СО (г) + 2Н2 (г), ∆ Н° х.р. = +247,4 кДж. (Ответ: 965,2 К). 3.11. а). Восстановление диоксида свинца водородом протекает по уравнению PbO2 (к) + H2 (г) = PbO (к) + H2O (г), ∆ Н° х.р. = −182,5 кДж. Вычислить стандартную энтальпию образования PbO2. (Ответ: −276,6 кДж/моль). б). Вычислить, при какой температуре начнется диссоциация пентахлорида фосфора, протекающая по уравнению PCl5 (г) = PCl3 (г) + Cl2 (г), ∆ Н° х.р. = +92,4 кДж.
3.12. а). Исходя из уравнения реакции горения ацетилена С2Н2 (г) + 5½О2 (г) = 2СО2 (г) + Н2О (г), D H° х.р. = –1255,6 кДж, вычислить, сколько теплоты выделится при сгорании 1 м3 С2Н2 при нормальных условиях. (Ответ: 56053,5 кДж). б). Какой из карбонатов ВеСО3, или СаСО3 можно получить по реакции взаимодействия соответствующих оксидов с СО2? Вывод сделать, вычислив ∆ G° х.р..
(Ответ: +31,2 кДж; –129,9 кДж). 3.13. а). Определить количество теплоты, выделившейся при взаимодействии 50 г фосфорного ангидрида с водой по реакции Р2О5 (к) + H2O (ж) = 2HPO3 (ж), если тепловые эффекты реакции равны: 2Р (к) + 5½O2 (г) = Р2О5 (к), ∆ Н° = –1492 кДж; 2Р (к) + H2 (г) + 3O2 (г) = 2HPO3 (ж), ∆ Н° = –1964,8 кДж. (Ответ: 65,8 кДж). б). Рассчитать стандартную энтропию оксида железа (III), если известно изменение энтропии реакции, протекающей по уравнению 4FeO (к) + O2 (г) = 2Fe2O3 (к), ∆ S° х.р.= –260,4 Дж/К. (Ответ: 89,9 Дж/моль К). 3.14. а). Определить тепловой эффект реакции, протекающей по уравнению PbO2 (к) + СО (г) = PbO (к) + СO2 (г). (Ответ: −223,7 кДж). б). Вычислить ∆ Н° х.р., ∆ S° х.р. и ∆ G° Т реакции, протекающей по уравнению Fe2O3 (к) + 3Н2 (г) = 2Fe (к) + 3Н2O (г). Возможна ли реакция восстановления Fe2O3 водородом при температурах 500 и 1500 К? (Ответ: 96,8 кДж; 138,8 Дж/К; 27,3 кДж; –111,7 кДж). 3.15. а). Определить стандартную энтальпию образования пентахлорида фосфора РСl5 из простых веществ, исходя из следующих термохимических уравнений: 2Р + 3Сl2 = 2РСl3, ∆ Н° = –554,0 кДж; РСl3 + Сl2 = РСl5, ∆ Н° = –92,4 кДж. (Ответ: –369,2 кДж/моль). б). При какой температуре наступит равновесие системы 4HCl (г) + O2 (г) = 2H2O (г) + 2Cl2 (г), ∆ Н° х.р.= –114,4 кДж.
3.16. а ). Вычислить тепловой эффект и написать термохимическое уравнение реакции между СН4 (г) и Н2О (г), в результате которой образуются СО (г) и Н2 (г). (Ответ: 206,2 кДж). б). Рассчитать энергию Гиббса химических реакций, протекающих по уравнениям: CaO (к) + Н2О (г) = Са(ОН)2 (к); Р2О5 (к) + 3Н2О (г) = 2Н3РО4 (к), и определить, какой из двух оксидов, CaO или Р2О5, при стандартных условиях лучше поглощает водяные пары. (Ответ: –65,5 кДж; –205,2кДж). 3.17. а). Определить стандартную энтальпию образования фосфина РН3, исходя из уравнения 2РН3 (г) + 4О2 (г) = Р2О5 (к) + 3Н2О (ж), D H° х.р.= –2360 кДж. (Ответ: 5,3 кДж/моль). б). Вычислить значения ∆ G° х.р. следующих реакций восстановления оксида железа (III): Fe2O3 (к) + 3Н2 (г) = 2Fe (к) + 3Н2О (г); 2Fe2O3 (к) + 3С (к) = 4Fe (к) + 3СО2 (г); Fe2O3 (к) + 3СO (г) = 2Fe (к) + 3СО2 (г). Протекание какой из этих реакций наиболее вероятно? (Ответ: +55 кДж; +298,4 кДж; –31,1 кДж). 3.18. а). При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Рассчитать тепловой эффект и написать термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислить энтальпию образования С2Н5ОН (ж). (Ответ: −1234,8 кДж; –277,6 кДж/моль.). б). Пользуясь значениями ∆ Н° х.р., ∆ S° х.р.,вычислить∆ G° реакции, протекающей по уравнению PbO2 + Pb = 2PbO. Определить, возможна ли эта реакция при 298 К.(Ответ: –157,3 кДж.). 3.19. а). При сгорании 9,3 г фосфора выделяется 223,8 кДж теплоты. Рассчитать энтальпию образования оксида фосфора (V). (Ответ: –1492 кДж.). б). Какой из двух процессов разложения нитрата аммония наиболее вероятен при 298 К? NH4NO3 (к) → N2O (г) + 2H2O (г); NH4NO3 (к) → N2 (г) + ½O2 (г) + 2H2O (г). Ответ обосновать, рассчитав ∆ G °х.р. (Ответ: –169,1 кДж; –273,3 кДж.). 3.20. а). Реакция горения метана протекает по уравнению СН4 (г) + 2О2 (г) = СО2 (г) + 2Н2О (г). Рассчитать тепловой эффект реакции и количество теплоты, которое выделится при сгорании 100 л метана при нормальных условиях. (Ответ: –802,2 кДж; 3581,3 кДж). б). Вычислить стандартную энергию Гиббса образования NH3, исходя из значений энтальпии образования NH3 и изменения энтропии (∆ S°) реакции N2 (г) + 3Н2 (г) = 2NH3 (г). (Ответ: – 16,7кДж/моль).
|

 = 115,9 кДж/моль.
= 115,9 кДж/моль.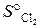 = 223 Дж/(моль∙К). (Ответ: 440 К).
= 223 Дж/(моль∙К). (Ответ: 440 К). = –944,8 кДж/моль;
= –944,8 кДж/моль; 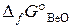 = –581,6 кДж/моль.
= –581,6 кДж/моль.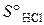 = 186,7 Дж/(моль∙К)? (Ответ: 891 К).
= 186,7 Дж/(моль∙К)? (Ответ: 891 К).


