Задачи и упражнения для самостоятельного решения. 4.1. Реакция протекает по уравнению 3Н2 + СО = СН4 + H2O.
4.1. Реакция протекает по уравнению 3Н2 + СО = СН4 + H2O. Начальные концентрации реагирующих веществ были (моль/л): (Ответ: увеличится в 5 раз). 4.2. Реакция разложения N2O идет по уравнению 2N2O = 2N2 + O2. Константа скорости реакции равна 5·10–4. Начальная концентрация Определить скорость реакции в начальный момент и в тот момент, когда разложится 50 % N2O. (Ответ: 5,12 . 10-5; 1,28 . 10-5). 4.3. Реакция между веществами А и В выражается уравнением А + 2В = D. Начальные концентрации (моль/л): С А = 0,3 и С В = 0,4. Константа скорости равна 0,8. Вычислить начальную скорость реакции и определить, как изменилась скорость реакции по истечении некоторого времени, когда концентрация вещества А уменьшилась на 0,1 моль. (Ответ: 3,84 . 10-2; уменьшилась в 6 раз). 4.4. Чему равен температурный коэффициент скорости реакции, если при понижении температуры на 30 °С, время протекания реакции увеличилось в 64 раза? (Ответ: 4). № 4.5. Вычислить, при какой температуре реакция закончится за 45 мин, если при 20 °С на это потребуется 3 ч. Температурный коэффициент скорости реакции равен 3. (Ответ: 33 °С). 4.6. Как изменится скорость реакции CO + Cl2 = COCl2, если повысить давление в 3 раза и одновременно повысить температуру на 30 °С (γ = 2)? (Ответ: увеличится в 72 раза). 4.7. Реакции протекают по уравнениям: С (к) + О2 (г) = СО2 (г); (1) 2СО (г) + О2 (г) = 2СО2 (г). (2) Как изменится скорость (1) и (2) реакций, если в каждой системе: а) уменьшить давление в 3 раза; б) увеличить объем сосуда в 3 раза; в) повысить концентрацию кислорода в 3 раза? (Ответ: а) уменьшится в (1) в 3, во (2) в 27 раз; б) уменьшится в (1) в 3, во (2) в 27 раз; в) увеличится в (1) и (2) в 3 раза). 4.8. Реакция идет по уравнению H2 + I2 = 2HI. Константа скорости равна 0,16. Исходные концентрации Н2 и I2 соответственно равны 0,04 и 0,05 моль/л. Вычислить начальную скорость реакции и ее скорость, когда концентрация Н2 станет равной 0,03 моль/л. (Ответ: 3,2 . 10-4; 1,9 . 10-4). 4.9. Окисление серы и ее диоксида протекает по уравнениям: S (к) + О2 (г) = SO2 (г); (1) 2SO2 (г) + О2 (г) = 2SO3 (г). (2) Как изменится скорость (1) и (2) реакций, если в каждой системе: а) увеличить давление в 4 раза; б) уменьшить объем сосуда в 4 раза; в) повысить концентрацию кислорода в 4 раза? (Ответ: а) увеличится в (1) в 4, во (2) − в 64 раза; б) увеличится в (1) в 4, во (2) − в 64 раза; в) увеличится в (1) и (2) в 4 раза. 4.10. Константа скорости реакции 2А + В = D равна 0,8. Начальные концентрации (моль/л): С А = 2,5 и С В = 1,5. В результате реакции концентрация вещества С В оказалась равной 0,6 моль/л. Вычислить, чему стала равна С А и скорость реакции. (Ответ: 0,7 моль/л; 0,235). 4.11. Реакция протекает по уравнению 4HCl + O2 = 2H2O + 2Cl2. Через некоторое время после начала реакции концентрации участвующих в ней веществ стали (моль/л): 4.12. Начальные концентрации веществ в реакции СО + Н2О ↔ СО2 + Н2 были равны (моль/л): C CO = 0,5; 4.13. Как изменится скорость реакции 2СО + О2 = СО2, если: а) объем реакционного сосуда увеличить 3 раза; б) увеличить концентрацию СО в 3 раза; в) повысить температуру на 40 °С (γ = 2)? (Ответ: а) уменьшится в 27 раз; б) увеличится в 9 раз; в) увеличится в 16 раз). 4.14. При 10 °С реакция заканчивается за 20 мин. Сколько времени будет длиться реакция при повышении температуры до 40 °С, если температурный коэффициент равен 3? (Ответ: 44,4 с). 4.15. Во сколько раз следует увеличить а) концентрацию СО в системе 2СО = СО2 + С, чтобы скорость реакции возросла в 4 раза? б) концентрацию водорода в системе N2 + 3H2 = 2NH3, чтобы скорость реакции возросла в 100 раз? в) давление в системе 2NO + O2 = 2NO2, чтобы скорость образования NO2 возросла в 103 раз? (Ответ: 2 раза; 4,64 раза; 10 раз). 4.16. Скорость реакции А + 2В = АВ2 при С А = 0,15 и С В = 0,4 моль/л равна 2,4∙10−3. Определить константу скорости и скорость реакции, когда концентрация В станет 0,2 моль/л. (Ответ: 0,1; 2∙10-4). 4.17. Как изменится скорость реакции 2А + В = А2В, если концентрацию вещества А увеличить в 3 раза, концентрацию вещества В уменьшить в 2 раза, а температуру повысить на 40 °С (γ = 2)? (Ответ: увеличится в 72 раза). 4.18. Реакция идет по уравнению 2H2S + 3O2 = 2SO2 + 2H2O. Через некоторое время после начала реакции концентрации участвующих в ней веществ стали (моль/л): 4.19. Две реакции протекают при 25 °С с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2, второй – 3. Найти отношение этих скоростей при 75 °С. (Ответ: V 2/ V 1 = 7,59). 4.20. Реакция идет по уравнению N2 + 3H2 = 2NH3. Через некоторое время после начала реакции концентрации реагирующих веществ были (моль/л):
|

 = 0,8; C CO = 0,6. Как изменится скорость реакции, если концентрацию водорода увеличить до 1,2, а концентрацию оксида углерода до 0,9 моль/л?
= 0,8; C CO = 0,6. Как изменится скорость реакции, если концентрацию водорода увеличить до 1,2, а концентрацию оксида углерода до 0,9 моль/л? = 0,32 моль/л.
= 0,32 моль/л. = 0,85;
= 0,85;  = 0,44;
= 0,44;  = 0,30. Вычислить начальные концентрации HCl и О2. (Ответ:
= 0,30. Вычислить начальные концентрации HCl и О2. (Ответ: 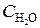 = 0,6;
= 0,6;  = 0,4;
= 0,4;  = 0, 009;
= 0, 009; 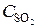 = 0,003. Вычислить: а) концентрацию водяного пара в этот момент; б) исходные концентрации сероводорода и кислорода. (Ответ:
= 0,003. Вычислить: а) концентрацию водяного пара в этот момент; б) исходные концентрации сероводорода и кислорода. (Ответ:  = 0,8;
= 0,8;  = 0,1. Вычислить концентрации веществ в момент, когда концентрация N2 стала 0,5 моль/л. (Ответ:
= 0,1. Вычислить концентрации веществ в момент, когда концентрация N2 стала 0,5 моль/л. (Ответ: 


