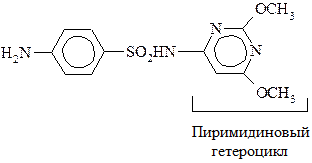Химические свойства. I. Оснóвные свойства
I. Оснóвные свойства Амины более сильные основания, чем NH3. Это объясняется + I эффектом радикалов. Чем больше электронная плотность на атоме N, тем больше основность. Вторичные амины более сильные основания, чем первичные. Основность третичных аминов уменьшается, что объясняется экранирующим влиянием атома N тремя алкильными группами. Поскольку электроотрицательность атома N меньше электроотрицательности атома О, амины образуют менее прочные ассоциаты, чем соответствующие спирты и имеют более низкие температуры кипения. Температура кипения этанола 78 оС, а этиламина – 17 оС. 1. При растворении в воде к аминам присоединяется Н+ от молекулы НОН, поэтому растворы аминов имеют щелочную реакцию: С2Н5 Гидроксидэтиламмония 2. При взаимодействии с кислотами образуются соли: С2Н5 Хлоридэтиламмония Щелочи разлагают соли аминов и выделяют свободные амины: [С2Н5 Особенно сильные оснóвные свойства у чертвертичных аммониевых оснований, которые по силе соответствуют щелочам:
Оснóвные свойства ароматических аминов ослаблены за счет р,p-сопряжения NH2 – группы с бензольным кольцом. Поэтому анилин образует соли только с сильными минеральными к-тами. Водный р-р анилина не изменяет окраску индикаторов. II. Реакции алкилирования и ацилирования В этом случае амины проявляют нуклеофильные свойства за счет электронной пары атома азота. 1. Реакция алкилирования (замещение атомов водорода в гр. NH2 на углеводородный радикал, в результате чего образуется вторичный амин): С2Н5NH2 + СН3CI → С2Н5NH-CH3 + HCI метилэтиламин 2. Реакция ацилирования (замещение атомов водорода в гр. NH2 на ацильный радикал):
Подобным образом алкилируется и ацилируется С6Н5NH2. С6Н5NH2 + СН3CI → С6Н5NH-CH3 + HCI (реакция алкилирования) С6Н5NH2 + СН3 COCI → С2Н5NH-C-CH3 + HCI (реакция ацилирования) ║ О III. Реакция с альдегидом с образованием основания Шиффа: С2Н5 – NH2 + O = IV. Качественные реакции на амины (реакция с HNO2) 1) С2Н5 – NH2 + O = N – OH 2) Желтый Нитрозоамины Нитрозоамины являются канцерогенными веществами. Нитраты в организме восстанавливаются до нитритов. 3) R3N: + НNO2 ® [R3NH]+NO2- Соль При действии HNO2 на соли анилина образуется не фенол, а соли диазония (широко используемые в химии красителей), которые при нагревании выделяют азот N2 с образованием фенола: [С6Н5 Соль диазония [С6Н5 V. Реакции по радикалу
Сульфаниловая кислота – важный продукт в синтезе лекарственных веществ (сульфаниламидных препаратов) и красителей. Наибольшую активность имеют производные сульфаниламидов, в которых атом Н в группе – SO2NH2 замещен на гетероцикл. Например, сульфадиметоксин:
Сульфаниламиды, являясь антиметаболитами n-аминобензойной к-ты (ПАБК), блокируют биосинтез фолиевой к-ты (витамин Вс), необходимой для нормального развития и размножения микроорганизмов. Сульфаниламиды имеют сходные геометрические параметры с ПАБК, что позволяет им встраиваться вместо последней в синтез фолиевой к-ты.
|

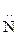 H2 + HOH ® [С2Н5
H2 + HOH ® [С2Н5  H3]OH-
H3]OH-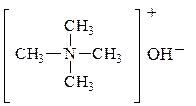

 – СН3
– СН3  С2Н5 – N =
С2Н5 – N =  С2Н5OH
С2Н5OH + HONO
+ HONO 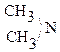 -NO¯
-NO¯ N2 + HCl + С6Н5OH
N2 + HCl + С6Н5OH