Относительная атомная масса элемента - это число, показывающее, во сколько раз масса одного атома данного элемента больше 1/12части массы атома изотопа углерода-12 (12С).
Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы
Моль — единица измерения количества вещества,
Моля́рная ма́сса вещества — отношение массы вещества к количеству моль этого вещества, то есть масса одного моля вещества
Молярная масса в граммах равна относительной атомной массе в таблице Менделеева.
Идеа́льный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией
0С= 273К – называется обсалютный 0 температур
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнениеМенделеева — Клапейрона) — формула, устанавливающая зависимость между давлением,молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
где · · · ·
Закон Бо́йля — Марио́тта — один из основных газовых законов, открытый в 1662 году Робертом Бойлем и независимо переоткрытый Эдмом Мариоттом в 1676 году[1]. Описывает поведение газа в изотермическом процессе. Закон является следствием уравнения Клапейрона[2]. При постоянных температуре и массе газа произведение давления газа на его объём постоянно. В математической форме это утверждение записывается в виде формулы
где
Закон Гей-Люссака — закон пропорциональной зависимости объёма газа от абсолютной температуры при постоянном давлении. Следует отметить, что в англоязычной литературе закон Гей-Люссака обычно называют законом Шарля и наоборот. Кроме того, законом Гей-Люссака называют также химический закон объёмных отношений.
Зако́н Ша́рля или второй закон Гей-Люссака — один из основных газовых законов, описывающий соотношение давления и температуры для идеального газа. Изохорический или изохорный процесс — термодинамический процесс, который происходит при постоянном объёме. Для осуществления изохорного процесса в газе или жидкости достаточно нагревать (охлаждать) вещество в сосуде, который не изменяет своего объёма. При изохорическом процессе давление идеального газа прямо пропорционально его температуре (см. Закон Шарля). В реальных газах закон Шарля не выполняется.
|

 . Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) термодинамической системы с микроскопическими (масса молекул, средняя скорость их движения).
. Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) термодинамической системы с микроскопическими (масса молекул, средняя скорость их движения). ,
, — давление,
— давление,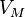 — молярный объём,
— молярный объём, — универсальная газовая постоянная
— универсальная газовая постоянная — абсолютная температура, К.
— абсолютная температура, К.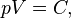
 — объём газа, а
— объём газа, а 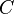 — постоянная в оговоренных условиях величина. В общем случае значение
— постоянная в оговоренных условиях величина. В общем случае значение 


