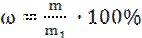Задания для самостоятельного выполнения. 1. Определите, во сколько раз увеличится скорость реакции при повышении температуры от 15 до 600 С, если температурный коэффициент реакции равен 2.
1. Определите, во сколько раз увеличится скорость реакции при повышении температуры от 15 до 600 С, если температурный коэффициент реакции равен 2. 2. Напишите математические выражения для скоростей реакций, протекающих по уравнениям: а) 4NH3 + 5O2 → 4NO + 6Н2O б) 2H2S+ SO2 → 3S + 2H2O в) Fe3O4 + 4H2 → 3Fe + 4H2O 3. Определите исходные концентрации NO и O2 и константу равновесия обратимой реакции вещества 2 NO + O2 ↔2 NO2, если равновесие установилось при следующих концентрациях реагирующих веществ: [NO2]=0,12 моль/л, [NO]=0,48 моль/л, [O2]=0,24 моль/л.
Форма контроля самостоятельной работы: выполнение и сдача лабораторной и практической работ.
Вопросы для самоконтроля по теме: 1. Что такое фаза химической системы? Как называются системы, которые состоят: а) из одной фазы; б) из двух и более фаз? 2. Что называется скоростью гомогенной реакции? Чему ровна скорость гомогенной реакции? 3. Что называется скоростью гетерогенной реакции? Чему ровна скорость гетерогенной реакции? 4. От каких факторов зависит скорость химической реакции? 5. Что называется химическим равновесием? 6. Какие факторы влияют на смещение химического равновесия? 7. Как формулируется принцип равновесия Ле-Шателье?
Тема 1.7 Растворы Основные понятия и термины по теме: растворы, растворитель, растворяемое вещество, сольваты, гидраты, кристаллогидраты, растворимость, коэффициент растворимости, концентрированный и разбавленный раствор, массовая доля растворенного вещества, молярная концентрация вещества. План изучения темы (перечень вопросов, обязательных к изучению): 1. Вода как растворитель. Механизм растворения веществ в воде. Понятие о растворах. 2. Концентрация растворов. Численные выражения состава растворов: массовая доля растворенного вещества (в %), молярная концентрация вещества. 3. Тепловые явления при растворении. Гидратная химическая теория растворов Д.И.Менделеева. 4. Растворимость веществ в зависимости от условий. Растворы ненасыщенные, насыщенные, пересыщенные. Коэффициент растворимости. Кривые растворимости. Кристаллизация веществ. Кристаллогидраты.
Краткое изложение теоретических вопросов: Растворы – это гомогенные (однородные) системы, состоящие из двух и более самостоятельных веществ и продуктов их взаимодействия. Растворение – сложный физико-химический процесс. Разрушение структуры растворяемого вещества и распределение его частиц между молекулами растворителя с частицами растворенного вещества – это физический процесс. Одновременно происходит взаимодействие молекулам растворителя с частицами растворенного вещества, т.е. химический процесс. В результате этого взаимодействия образуются сольваты. Сольваты – продукты переменного состава, которые образуются при химическом взаимодействии частиц растворенного вещества с молекулами растворителя. Если растворителем является вода, то образующиеся сольваты называются гидратами. Процесс образования сольватов называется сольватацией. Процесс образования гидратов называется гидратацией. Кристаллические вещества, содержащие молекулы воды, называются кристаллогидратами. Вода, входящая в их состав, называется кристаллизационной водой. Одни вещества хорошо растворяются, другие – плохо. При растворении веществ образуются насыщенные и ненасыщенные растворы. Насыщенный раствор – это раствор, который содержит максимальное количество растворяемого вещества при данной температуре. Ненасыщенный раствор – это раствор, который содержит меньше растворяемого вещества, чем насыщенный при данной температуре. Вещество, взятое в избытке и служащее средой, в которой идет растворение, называется растворителем. Вещество, которое растворяется, называется растворяемым веществом. Можно приготовить растворы с различным содержанием растворяемого вещества. Поэтому для каждого раствора необходимо узнать концентрацию. Концентрацией раствора называется массовое содержание растворенного вещества в определенном массовом количестве или определенном объеме раствора. Массовая доля растворенного вещества ω; – это отношение массы растворенного вещества к общей массе раствора.Ее выражают в долях единицы (или в процентах):
где m – масса растворенного вещества; m1 - масса раствора.
|