Практическое занятие
Определение характера химической связи в различных химических соединениях. Задания для самостоятельного выполнения: 1. Для каких веществ характерна ионная связь: H2, KCI, KH, CaF2, CH4? Напишите схемы образования этих веществ. 2. Изобразите образование химических связей в молекулах следующих веществ: CI2, SiF4, NCI3, I2. 3. Составьте структурные и электронные формулы для следующих соединений: NH3, O2, HCI, H2SO4, F2.
Форма контроля самостоятельной работы: выполнение и сдача практической работы.
Вопросы для самоконтроля по теме: 1. Что называется ковалентной связью? Для каких веществ она характерна? Механизм ее образования. 2. Что называется ионой связью? Для каких веществ она характерна? Механизм ее образования. 3. Что называется металлической связью? Для каких веществ она характерна? 4. Что называется водородной связью? Для каких веществ она характерна? 5. Структурные формулы. Электронные формулы молекул. 6. Назовите типы кристаллических решеток. Охарактеризуйте отличительные физические свойства веществ, которые имеют различные типы кристаллических решеток.
Тема 1.5 Окислительно-восстановительные реакции. Электролиз Основные понятия и термины по теме: окислитель, восстановитель, процесс окисления, процесс восстановления, степень окисления, электролиз, его процесс. План изучения темы (перечень вопросов, обязательных к изучению): 1. Степень окисления. Химические реакции с изменением и без изменения степени окисления. 2. Виды окислительно-восстановительных реакций. Важнейшие окислители и восстановители. 3. Расстановка коэффициентов в уравнениях окислительно-восстановительных реакций методом электронного баланса. 4. Сущность электролиза. Электролиз расплавов и водных растворов электролитов. Применение электролиза.
Краткое изложение теоретических вопросов: Реакции, в результате которых изменяется степень окисления элементов, называются окислительно – восстановительными. Существует несколько способов составления уравнений окислительно-восстановительных реакций. Метод электронного баланса, основанный на определении общего числа перемещающихся электронов. Например: MnO2 +KClO3 + KOH = K2MnO4 + KCl + H2O Определяем, атомы каких элементов изменили степень окисления:
Определяем число потерянных (-) и полученных (+) электронов:
Число потерянных и полученных электронов должно быть одинаковым. Оба процесса полуреакций изобразим следующим образом:
Основные коэффициенты при окислителе и восстановителе переносим в уравнение реакции 3MnO2 +KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O Процесс превращения марганца +4 в марганец +6 есть процесс отдачи (потери) электронов, т.е. окисление; процесс превращения Cl+5 в Cl-1 есть процесс получения электронов, т.е. процесс восстановления. Вещество MnO2 при этом является восстановителем, KClO3 – окислителем.
|


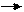 Mn+4 Mn+6 Cl+5 Cl-1
Mn+4 Mn+6 Cl+5 Cl-1
 Mn +4– 2ē Mn+6 Cl +5+ 6ē Cl-1
Mn +4– 2ē Mn+6 Cl +5+ 6ē Cl-1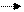


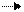 восстановитель Mn+4 – 2ē Mn+6 3 3 Mn – 6ē 3Mn окисление
восстановитель Mn+4 – 2ē Mn+6 3 3 Mn – 6ē 3Mn окисление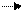
 окислитель Cl+5 + 6ē Cl-1 1 Cl+5 + 6ē Cl-1 восстановление
окислитель Cl+5 + 6ē Cl-1 1 Cl+5 + 6ē Cl-1 восстановление


