Введение. Предмет неорганической химии, его задачи
Предмет неорганической химии, его задачи. Роль неорганической химии в развитии важнейших отраслей промышленности и сельского хозяйства. Охрана окружающей среды.
Тема 1.1 Основные понятия и законы химии. Основные понятия и термины по теме: атом, химический элемент, молекула, масса атома, моль, молярная масса, молярный объем, закон постоянства состава веществ, закон сохранения массы веществ, газовые законы. План изучения темы (перечень вопросов, обязательных к изучению): 1. Атом, химический элемент, молекула, масса атома. 2. Простые и сложные вещества, моль, молярная масса, молярный объем, характеристика простых веществ 3. Химические реакции. Классификация реакций. 4. Закон постоянства состава вещества, закон сохранения массы вещества, закон Авогадро. 5. Относительная плотность газов, массовые доли элементов и химических соединений. Краткое изложение теоретических вопросов: Атомно-молекулярное учение дает объяснение основным понятиям и законам химии. Атом - электронейтральная система, состоящая из элементарных частиц. Химический элемент – вид атомов, характеризующихся одинаковым зарядом ядра. Молекула - устойчивая совокупность атомов, удерживаемых силами притяжения (химическими связями). Масса атома (ma (X)) выражается в килограммах, граммах: ma (Н) = 1,67 ∙ 10-27 кг, или 1,67 ∙ 10-24 г; Пользоваться такими числами при расчетах неудобно. Поэтому применяют не абсолютные значения масс атомов, а относительные. За единицу атомной массы в химии и физике принята атомная единица массы. Атомная единица массы (а. е. м) - 1 а.е.м = Относительная атомная масса (Ar) – величина, равная отношению средней массы атома естественного изотопического состава (ma (X)) к атомной единицы массы (а.е.м.):
Относительная молекулярная масса (Mr (X)) – величина, равная отношению средней массы молекулы естественного изотопического состава вещества к атомной единице массы:
Таким образом, относительная атомная и молекулярные массы показывают, во сколько раз масса атома данного элемента и масса молекулы данного вещества больше одной а.е.м. Моль – количество вещества, содержащее столько структурных частиц атомов, молекул, ионов и других частиц, сколько атомов содержится в углероде 12С массой 0,012 кг. Количество вещества системы, содержащей 6,02 Молярная масса (M) вещества Х равна отношению массы (m) вещества к соответствующему количеству вещества (n):
Молярная масса устанавливает связь между количеством вещества и его массой и обозначается кг/моль или г/моль. Например,
Молярная масса численно равна относительной молекулярной массе. Например, M (O2)= 32 г/моль; Mr (O2)=32. Молярный объем – (Vm) – это отношение объема газообразного вещества к количеству вещества в этом объеме при любых условиях:
При нормальных условиях (н.у.) объем 1 моль любого газа равна 22,4 л. Постоянная Относительная плотность газов (D)- это отношение масс равных объемов различных газов при одинаковых условиях (p, T одинаковы для обоих газов): D=m1/m2 при V1=V2. При этих условиях, согласно закону Авогадро, в данных газах содержится одинаковое число молекул. Но массы взятых газов окажутся неодинаковыми, следовательно они будут относительно друг к другу как их молярные массы: Если плотность измерена по водороду (DH2): Mr2 = 2, то Mr1 = 2 DH2. Если плотность измерена по воздуху (Dвозд): Mr2=29, то Mr1 = 29 Dвозд , где 29 – средняя молекулярная масса воздуха.
|

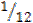 массы атома изотопа углерода 12С:
массы атома изотопа углерода 12С: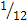 ma (С)=
ma (С)= 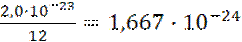 г.
г.
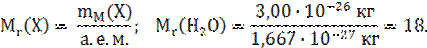
 1023 атомов или 6,02
1023 атомов или 6,02 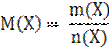
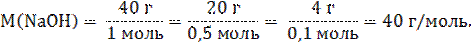
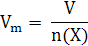
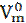 равная 22,4 л/моль, называется молярным объемом газа при нормальных условиях.
равная 22,4 л/моль, называется молярным объемом газа при нормальных условиях.



