Теоретическая часть. Что называется термодинамикой?
Теоретическая часть Для характеристики тепловых свойств газа, как и всякого другого тела, пользуются особой величиной - теплоемкостью. Теплоемкостью тела называют количество теплоты, которое нужно подвести к нему или отнять от него для изменения его температуры на 1 К:
Теплоемкость, отнесенная к единице массы вещества, называется удельной теплоемкостью. Она, очевидно, характеризует уже не тело, а вещество, из которого это тело состоит. Теплоемкость, отнесенная к одному молю вещества, называется молярной теплоемкостью. Между удельной теплоемкостью - c и молярной - C существует очевидное соотношение:
где М - молярная масса (измеряется в кг/моль). Теплоемкость газа зависит от условий его нагревания. В частности, газ можно нагревать при постоянном объеме V или при постоянном давлении Р. Соответственно получаем теплоемкость при постоянном объеме Cv и теплоемкость при постоянном давлении Cp. Отношение Сp/Сv = γ является параметром при адиабатных процессах и при процессах, близких к ним (γ; называют коэффициентом Пуассона). Процесс называется адиабатным, если в этом процессе нет теплообмена газа с окружающей средой (стенки сосуда теплоизолированы). Если адиабатный процесс является равновесным (в каждый момент времени давление Р и температура Т одинаковы по всему объему), то он описывается уравнением Пуассона РVγ = const. Согласно первому началу термодинамики ∆Q = ∆U +∆A, где ∆Q - количество теплоты, сообщенное газу, ∆U - изменение внутренней энергии газа, ∆A - работа, совершенная газом над внешними телами. Рассмотрим один моль газа. Если V = const, то ∆A = 0 и, следовательно, Следовательно,
Таким образом, молярные теплоемкости Cp и Сv для идеального газа связаны соотношением Cp = Сv + R, где R - универсальная газовая постоянная. Cp > Сv, так как при V = const вся сообщаемая газу теплота идет только на изменение внутренней энергии газа, тогда как при Р = const нагревание газа неизбежно сопровождается его расширением. При этом газ совершает работу, для чего приходится сообщать ему дополнительное количество теплоты. В молекулярно-кинетической теории газов показывается, что Для одноатомных молекул i = 3 (например, инертные газы), для двух атомной жесткой молекулы (расстояние между молекулами постоянно) i = 5. Именно такими являются молекулы N2 и О2 в воздухе при комнатных температурах и, следовательно, для них
|

 .
. ,
, .
.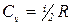 , где i - число степеней свободы одной молекулы - число независимых координат, с помощью которых однозначно определяется положение и ориентация молекулы в пространстве.
, где i - число степеней свободы одной молекулы - число независимых координат, с помощью которых однозначно определяется положение и ориентация молекулы в пространстве.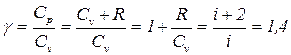 .
.


