Коррозия и защита металлов
Пример 1. Возможна ли коррозия сплава, состоящего из мелкодисперсных кристаллов висмута и свинца: а) в аэрируемой воде; б) в изолированном от воздуха сосуде с водой? Для среды, в которой коррозия возможна, составьте схему микрогальванических элементов, возникающих в процессе коррозии. Составьте уравнения анодного и катодного процессов и результирующее (суммарное) уравнение процесса коррозии.
Решение. Как любой окислительно-восстановительный процесс, коррозия возможна, если потенциал окислителя больше потенциала восстановителя (Eокисл > Eвосст). Отсюда следует, что в первую очередь будет окисляться, т.е. корродировать, металл, имеющий меньший электродный потенциал. Таким металлом в данном примере является свинец ( а) В аэрируемой воде из двух возможных окислителей – иона водорода воды H+ и растворенного в воде кислорода O2 – более сильным окислителем является кислород, так как его потенциал больше (в нейтральной среде Схема гальванического элемента: Pb | O2; H2O | Bi. Анодом является свинец, катодом – висмут. Протекают процессы:
Анод Pb – 2 Катод O2 + 4 2Pb + O2 + 2H2O = 2Pb(OH)2 ↓;
Продуктом коррозии является труднорастворимый гидроксид свинца Pb(OH)2.
б) В отсутствие кислорода единственным окислителем могли бы быть ионы водорода из воды. Но поскольку Eокисл = –0,41 В < Eвосст = –0,13 В, коррозия невозможна.
Пример 2. Какие процессы будут протекать при коррозии бериллия и меди, находящихся в контакте? Составьте уравнения анодного и катодного процессов и результирующее (суммарное) уравнение процесса коррозии в следующих средах: а) во влажном воздухе; б) в растворе гидроксида натрия; в) в растворе хлороводородной кислоты.
Решение. Из контактирующих металлов более активным восстановителем является бериллий, так как
а) Во влажном воздухе окислителем является кислород. Коррозия возможна, так как его потенциал значительно больше потенциала бериллия. Бериллий будет являться анодом и окисляться, а медь – катодом, где будет восстанавливаться кислород:
Анод Be – 2 Катод O2 + 4 2Be + O2 + 2H2O = 2Be(OH)2 ↓;
Продуктом коррозии является труднорастворимый гидроксид бериллия.
б) Поскольку гидроксид бериллия амфотерен, в щелочном растворе процесс анодного окисления бериллия заканчивается образованием гидроксокомплекса:
Анод Be – 2
Несмотря на то, что потенциал кислорода больше, чем иона водорода воды, доступ кислорода к поверхности катода (медь) ограничен из-за малой его растворимости и медленной диффузии. Поэтому в щелочном растворе (pH 14) при условии
Катод 2H2O + 2
Результирующее уравнение процесса коррозии получим, суммируя уравнения анодного и катодного процессов:
Be + 2H2O + 2OH– = [Be(OH)4]2– + H2
или
Be + 2H2O + 2NaOH = Na2[Be(OH)4] + H2
в) По тем же кинетическим причинам, что и в предыдущем случае, окислителем является ион водорода H+. Уравнения процессов:
Анод Be – 2 Катод H2 + 2 Be + 2H2 = Be2+ + H2
или
Be + 2HCl = BeCl2 + H2
|

 = –0,13 В <
= –0,13 В < 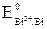 = +0,22 В). Окислителем будут те ионы или молекулы в окружающей среде, которые имеют больший потенциал.
= +0,22 В). Окислителем будут те ионы или молекулы в окружающей среде, которые имеют больший потенциал.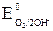 = +0,81 В >
= +0,81 В > 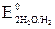 = –0,41 В). Коррозия возможна, так как Eокисл = +0,81 В > Eвосст = –0,13 В.
= –0,41 В). Коррозия возможна, так как Eокисл = +0,81 В > Eвосст = –0,13 В.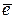 = Pb2+ │ 2
= Pb2+ │ 2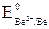 = –1,85 В <
= –1,85 В < 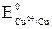 = +0,34 В, поэтому, в первую очередь, корродирует бериллий.
= +0,34 В, поэтому, в первую очередь, корродирует бериллий.


