Электролиз. Пример 1. Составьте уравнения электродных процессов, протекающих при электролизе водного раствора Bi2(SO4)3 в электролизерах: а) с угольными электродами; б) с
Пример 1. Составьте уравнения электродных процессов, протекающих при электролизе водного раствора Bi2(SO4)3 в электролизерах: а) с угольными электродами; б) с висмутовыми электродами. Для каждого варианта вычислите массы веществ, полученных (или растворенных) на электродах, если через электролизеры пропущен ток силой 10,0 А в течение 1 ч 10 мин. Для газообразных веществ определите их объем при н.у.
Решение. а) На катоде в первую очередь протекает восстановление наиболее сильных окислителей, характеризующихся бόльшим потенциалом. К отрицательно заряженному катоду движется катионы Bi3+, которые могут восстанавливаться до металлического висмута (
Bi3+ + 3
К положительно заряженному аноду движутся анионы
2H2O – 4
По законам Фарадея масса восстановленного на катоде висмута:
где I – сила тока, А; τ – продолжительность электролиза, с; F – константа Фарадея, 96 500 Кл.
Масса выделившегося на аноде кислорода:
где
Объем, занимаемый газом при н.у., определяется по формуле:
где n – количество газа, моль; m – масса газа, г; M – молярная масса газа, V0 = 22,4 л – объем одного моль газа при н.у.
Для кислорода
б) На висмутовом аноде кроме окисления воды возможно окисление висмута – материала анода. На аноде протекает, в первую очередь, окисление наиболее сильных восстановителей, характеризующихся меньшим потенциалом. Поскольку
Bi – 3
На катоде, как и в варианте (а), восстанавливается висмут:
Bi3+ + 3
Массы осажденного на катоде и растворенного на аноде висмута одинаковы и определяются уравнением (1): на катоде из раствора восстановилось 30,3 г висмута и столько же висмута растворилось на аноде.
Пример 2. При электролизе водных растворов AgNO3 и NiSO4 в двух электролизерах, соединенных последовательно, на катодах выделилось соответственно серебро массой 5,39 г и никель массой 1,39 г. Определите выход по току никеля, если выход по току серебра 100%. Какова продолжительность электролиза при силе тока 5,00 А?
Решение. Если на электроде возможно одновременно протекание нескольких процессов, то используют понятие выхода по току. Выходом по току i-го вещества (Bi) называется доля общего количества электричества в процентах, которая расходуется на окисление или восстановление i-го вещества при электролизе
где Q = I·τ – общее количество прошедшего электричества; Qi – количество электричества, израсходованное на окисление или восстановление i-го вещества; mi – масса i-го вещества, окисленного или восстановленного на электроде; mi(τ) – то же, теоретически рассчитанное из предположения 100%-ного выхода по току.
Из законов Фарадея по массе выделившегося серебра при 100%-ном выходе по току определим продолжительность электролиза τ:
Рассчитаем массу никеля, которая выделилась бы при 100%-ном выходе по току
Выход по току никеля
Пример 3. В течение какого времени следует проводить электролиз при силе тока 8,00А для выделения на катоде всей меди, содержащейся в 250 мл 0,100 М раствора CuSO4?
Решение. Из законов Фарадея
или
где nэк(Cu) – количество моль эквивалентов меди. Количество моль меди в растворе
nCu = cV = 0,100·0,250 = 0,0250 моль,
где c – молярная концентрация CuSO4, V – объем раствора, л.
Поскольку эквивалент меди ЭCu = ½; Cu, то nэк(Cu) = 2nCu = = 2·0,0250 = 0,0500 моль. Подставим значение nэк(Cu) в уравнение (2):
|

 + 0,22 В) и полярные молекулы воды, которые могут восстанавливаться до водорода (
+ 0,22 В) и полярные молекулы воды, которые могут восстанавливаться до водорода ( = 0,00 В при pH 0;
= 0,00 В при pH 0;  = Bi
= Bi и полярные молекулы воды. В сульфат-ионе сера находится в высшей степени окисления (+6), поэтому дальнейшее окисление серы невозможно. В данных условиях протекает единственно возможный процесс – окисление воды до кислорода:
и полярные молекулы воды. В сульфат-ионе сера находится в высшей степени окисления (+6), поэтому дальнейшее окисление серы невозможно. В данных условиях протекает единственно возможный процесс – окисление воды до кислорода: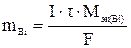 , (1)
, (1) ;
; = 30,3 г.
= 30,3 г. = 3,48 г,
= 3,48 г, .
. ,
, ;
; = 2,44 л.
= 2,44 л.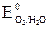 = +1,23В, то окисляться будет материал анода:
= +1,23В, то окисляться будет материал анода: ,
, = 964 с = 16 мин 4 с.
= 964 с = 16 мин 4 с. = 1,47 г.
= 1,47 г. = 94,6%.
= 94,6%. ,
,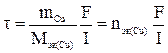 , (2)
, (2) ;
; = 603 c = 10 мин 3 с.
= 603 c = 10 мин 3 с.


