Визначення групи дубильних речовин
Реакція із солями Fe (III) Реакція використовується для відкриття дубильних речовин у рослинному матеріалі. Виконання реакції. До 1–3 мл екстракту додають 3 краплі 1%-го розчину залізоамонійних галунів. Гідролізовані дубильні речовини дають при цьому чорно-синє забарвлення, а конденсовані – чорно-зелене. Реакція із бромною водою Виконання реакції. До 5 мл екстракту додають декілька крапель бромної води до появи запаху брому. Конденсовані дубильні речовини утворюють жовтий або помаранчевий осад. Реакція із середнім ацетатом свинцю Виконання реакції. До 1–2 мл екстракту додають 2 мл 10%-ї оцтової кислоти та 1 мл 10%-го розчину середнього ацетату свинцю. При наявності гідролізованих дубильних речовин з’являється білий осад, нерозчинний в оцтовій кислоті (осад конденсованих дубильних речовин розчиняється в надлишку оцтової кислоти). Осад відфільтровують та до фільтрату додають 10 крапель 1%-го розчину залізоамонійних галунів. При наявності конденсованих дубильних речовин фільтрат набуває чорно-зеленого кольору. Реакція Стіасні Реакція заснована на осадженні катехінів з формальдегідом у кислому середовищі. Виконання реакції. До 25 мл екстракту додають 5 мл 40%-го розчину формальдегіду та 3 мл концентрованої хлористоводневої кислоти. Суміш кип’ятять на водяній бані 30 хв у колбі зі зворотнім холодильником. При наявності конденсованих дубильних речовин з’являється осад цегляного кольору. Реакція з нітритом натрію Виконання реакції. До 2–3 мл екстракту додають декілька кристалів нітриту натрію та 0,5 мл хлористоводневої кислоти. При наявності гідролізованих дубильних речовин розчин набуває кармінно-червоного забарвлення. Реакція з розчином ваніліну Виконання реакції. На скло наносять 2–3 краплі екстракту та додають декілька капель розчину ваніліну в кислому середовищі. При наявності конденсованих дубильних речовин розчин набуває червоного забарвлення. Реакция з нітрозометилуретаном Виконання реакції. При кип’ятінні розчинів дубильних речовин з нітрозометилуретаном таніди пірокатехінового ряду утворюють осад, а наявність пірогалолових танідів можна відкрити у фільтраті шляхом додавання залізоамонійних галунів та ацетату натрію – фільтрат забарвлюється у фіолетовий колір. Контрольні запитання 1. Які речовини належать до групи дубильних речовин? Які основні класи цих речовин? 2. Якими методами виділяються дубильні речовини з рослинної сировини? 3. Які є якісні реації на дубильні речовини? 4. Які реакції використовуються для визначення групи дубильних речовин, що переважає в даному виді рослинної сировини?
Лабораторна робота 10 Мета роботи: провести кількісне визначення дубильних речовин. Реактиви: KMnO4, індигосульфокислота, залізоамонійні галуни.
Визначення кількісного вмісту таніну проводять перманганатометричним методом за ДФ XІ. Методика роботи. Близько 2 г (точна наважка) подрібненої сировини, просіяної крізь сито з діаметром отворів 3 мм переносять у конічну колбу на 100 мл, заливають 50 мл окропу і настоюють на водяній бані протягом 30 хв при постійному перемішуванні. Рідину відстоюють протягом декількох хвилин та обережно проціджують через вату в мірну колбу місткістю 250 мл (частки сировини не повинні потрапляти на вату). Сировину в колбі повторно екстрагують киплячою водою, як указано вище, проціджуючи рідину в ту ж саму мірну колбу. Екстракцію повторюють декілька разів до негативної реакції на дубильні речовини (проба з розчином залізоамонійних галунів). Рідину в мірній колбі охолоджують і об’єм доводять водою до мітки. 25 мл отриманої рідини переносять в конічну колбу на 1 л, додають 75 мл води і 25 мл розчину індигосульфокислоти і титрують при постійному перемішуванні 0,1 н. розчином перманганату калію до золотисто-жовтого забарвлення. 1 мл 0,1 н. розчину перманганату калію відповідає 0,004157 г дубильних речовин у перерахунку на танін. Паралельно проводять контрольний дослід: титрують 25 мл індигосульфокислоти в 750 мл води. Вміст дубильних речовин визначають за формулою:
де; Vn – об’єм екстракту, взятого для титрування, мл; Vn – загальний об’єм екстракту, мл; a – маса наважки, г.
Контрольні запитання. 1. Чим відрізняються гідролізовані дубильні речовини від конденсованих? 2. Які методи використовуються для визначення кількісного вмісту танінів? 3. У чому полягає суть методу Левенталя?
Лабораторна робота № 11 Мета роботи: провести виділення пектину з рослинної сировини та визначити його кількісний вміст. Реактиви: Pb(CH3COO)2, NaOH, CH3COOH, CaCl2, AgNO3, цукровий пісок, лимонна кислота
Пектин (Е 440) міститься в усіх рослинах, входить до складу клітинних стінок. Особливо багаті ним фрукти та ягоди. При нагріванні з кислотою і цукром пектин утворює драглеподібну масу. Пектин – високомолекулярна речовина (М.м. до 200000). Його структурна основа – частково етерифікована метиловим спиртом полігалактуронова кислота.
Через здатність утворювати желе пектин використовується в харчовій промисловості для виготовлення мармеладу, джемів й інших продуктів. Сировиною для одержання пектину служать яблука, скоринки цитрусових плодів, соняшник, буряк тощо.
|

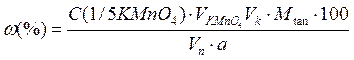 ,
,



