Лабораторные опыты учащихся по химии
Лабораторные опыты по химии могут быть индивидуальными (опыты выполняют все учащиеся индивидуально), групповыми (учащиеся, сидящие за одним столом, выполняют одну и ту же работу, но функции между ними распределены), коллективными (учащиеся, сидящие за разными столами, выполняют разные опыты, а затем, получив результат, докладывают о нем в классе и делают коллективные выводы). Место лабораторного опыта в структуре урока, как правило, отводится в процессе изучения нового материала; учащихся можно о нем заранее не предупреждать. Успех лабораторного опыта на уроке зависит от его подготовки. Прежде всего нужно продумать расстановку и подбор оборудования на каждом столе (если кабинет не имеет типового оборудования ученических рабочих мест). Отсутствие любой детали, нехватка пробирки и т. п. может дезорганизовать работу класса. Реактивы в емкостях с этикетками должны быть обязательно проверены. Если часть реактивов приходится выдавать в пробирках, то последние следует пронумеровать и сделать запись на доске — в какой пробирке какое вещество находится. Полезно завести картотеку, где на каждой карточке дан перечень оборудования к каждому лабораторному опыту. Необходимо продумать разделение обязанностей между учащимися, сидящими за одним столом. В целях соблюдения правил техники безопасности более сложные опыты лучше делать не индивидуально, а группой учащихся (два человека), сидящих за одним столом. Во время работы необходимо руководить учащимися, но ничего не объяснять, чтобы не отвлекать их внимания: отмечать, кто как работает, кто нарушает правила техники безопасности, делать замечания в случае нарушения дисциплины, следить за результатами. В конце работы нужно оставить несколько минут на уборку, заранее продумав ее. После окончания работы организовывают обсуждение ее результатов. Оформлять результаты опыта следует в рабочих тетрадях. Хотя единых требований к оформлению записей | ||||||||||||
| 85. | опытов нет, лучше осуществлять их по графам, так как без них учащиеся пишут очень много лишних слов. Часть тетрадей учитель после лабораторного опыта собирает, но оценку ставит только тем учащимся, которые были взяты специально под контроль, так как охватить всех учащихся целенаправленным наблюдением невозможно. Поскольку лабораторные работы проводятся в процессе объяснения материала, их приходится проводить так, чтобы не терялась нить изложения. Однако при этом недостаточное внимание уделяется формированию практических умений и навыков. Практические занятия по химии, формирование химических умений учащихся Выработке умений и навыков уделяется очень большое внимание на практических занятиях, которые проводятся уже с VIII класса, где играют особенно большую роль. Они образуют строгую систему формирования практических умений. Вначале изучаются некоторые приемы препаративной химии — приобретаются умения обращаться с нагревательными приборами, инструментами, осваиваются приемы лабораторной техники (нагревание веществ, разделение смесей), изучаются элементарные правила техники безопасности. Затем учащиеся получают простое вещество, например кислород, при разложении сложного и исследуют его свойства. Следующий этап — получение сложного вещества, например сульфата меди, и выделение его из раствора, затем приготовление раствора из сухого вещества. Если все предыдущие работы носили качественный характер, то последняя — количественный. Учащиеся пользуются весами, мерной посудой. И, наконец, экспериментальное решение задач, где от учащихся уже требуется большая самостоятельность. Таким образом, в VIII классе закладываются основы практических умений, которые в последующих классах получают развитие и совершенствуются. Если обучению в VIII классе предшествовал пропедевтический этап в VII классе, то учитель может сэкономить время на препаративных опытах, которые обычно уже освоены, и больше внимания уделить более сложным. Практические занятия бывают двух видов: проводимые по инструкции и экспериментальные задачи. Инструкция — это ориентировочная основа деятельности учащихся. В ней подробно в письменном виде изложен каждый этап выполнения опытов, оговариваются даже возможные ошибочные действия учащихся и даются указания, как их избежать. В ней содержится информация и о мерах безопасности при выполнении | |||||||||||
| 86. | работы. Инструкции к лабораторным опытам и практическим работам напечатаны в учебнике, в специальной рубрике. Чем младше учащиеся, тем подробнее инструкция. Однако для выполнения работы только письменной инструкции недостаточно. Необходим грамотный, четкий показ лабораторных приемов и манипуляций в процессе предварительной подготовки к практической работе. Экспериментальные задачи не содержат инструкции, а только условие. Разрабатывать план решения и осуществить его учащиеся должны самостоятельно. Подготовка к практическому занятию осуществляется учителем не на одном уроке, который предшествует практическому занятию, а в течение всей темы. Так, например, в IX классе в работе «Получение аммиака и опыты с ним. Ознакомление со свойствами водного раствора аммиака» обобщаются сведения об аммиаке и его соединениях: о щелочной реакции раствора аммиака в воде, о взаимодействии аммиака с хлороводородом в газовой фазе, о растворимости аммиака и о динамическом равновесии между гидратом аммиака и газообразным аммиаком и т. д. При изучении реакции солей аммония с сильными основаниями одновременно рассматривается способ получения аммиака. Конкретизируется понятие об условиях протекания реакций (между сухими веществами, при нагревании); обосновывается конструкция прибора (наклон пробирки, направление газоотводной трубки). Все это предшествует практическому занятию, и учитель обязан устанавливать перспективные внутрипредметные связи. Например, при изучении свойств аммиака на уроке учитель использует прибор для его получения, которым учащиеся будут пользоваться на практическом занятии, и т. д. За урок до проведения практического занятия необходимо ознакомить учащихся с конструкциями приборов, приемами лабораторной техники, проанализировать цели и содержание работы и увязать это с домашним заданием по анализу инструкции. В зависимости от подготовленности класса нужно показать, как соотносить цели опыта и его результат, на какие вопросы дать ответ, чтобы сделать вывод. На практическом занятии в начале урока должна быть проведена краткая беседа о правилах техники безопасности и о узловых моментах работы. На демонстрационном столе размещают в собранном виде все используемые в работе приборы. Очень важно, чтобы работа была учителем выверена во времени. Необходимо помнить, что учащиеся VIII и IX классов очень медленно пишут. | |||||||||||
| 87. | В начале работы нужно провести краткую беседу о домашней подготовке к работе, проверить знание приемов и, если надо, напомнить о них снова, ответить на вопросы учащихся, предупредить о технике безопасности.
Оформить работу учащиеся должны тут же на уроке. За отчет по практической работе ставят оценку, так как нельзя недооценивать его обучающую роль.
Практическое занятие относится к сложному виду урока еще и потому, что учителю не удается полноценно вести наблюдение за формированием практических умений у каждого учащегося в классе и их учет. Нередко он сводится к проверке письменных отчетов, и у учащихся возникает впечатление, что отчет — это главное в работе. Иногда на вопрос: «Чем вы занимались на уроке химии?» приходится слышать от учащихся ответ: «Писали практическую работу». Таким образом, формирование экспериментальных умений отступает на второй план, что недопустимо.
Решить эту организационно сложную проблему можно, подготовив заранее из числа учащихся класса нескольких (обычно 5-6 человек) учеников-прокторов. Проктор — это ученик, который помогает учителю во время проведения практического занятия. Это может быть член кружка, ученик, интересующийся предметом, или просто желающий. Учитель приглашает прокторов во внеурочное время в кабинет химии и предлагает им выполнить предстоящую работу под своим наблюдением, обращая внимание на возможные ошибки и тонкости.
Затем каждому проктору выдается лист учета и разъясняется, как его следует заполнять. Пример такого листа приводится на табл. 2.2.
Таблица 2.2. ЛИСТ УЧЕТА
Практическая работа на тему___________________________________
| |||||||||||
| 88. | Прокторов нужно учить еще и общению, стилю поведения. Важно, чтобы они не вели себя высокомерно, а действовали в контакте, совместно со своими товарищами. После этого уже на уроке прокторам поручается курировать микрогруппу из трех-четырех учеников, сидящих за соседними столами, во время выполнения ими практической работы. Если ученик правильно, самостоятельно, без вмешательства проктора выполнил операцию, то он получает за нее 1 балл, если неправильно, то «О». Заполненный лист учета сдается учителю по окончании работы и обязательно учитывается вместе с проверкой отчета в тетрадях. Если от учеников на проктора поступает жалоба, то учитель обязательно должен в ней разобраться и вынести справедливое решение. Прокторы не только контролируют работу учащихся, но и оказывают им необходимую помощь, поясняют то, что непонятно, т. е. принимают на себя в своей микрогруппе некоторые функции учителя, следят за порядком. Эта методика была подробно разработана П. И. Беспаловым.1 Практическая работа, посвященная решению экспериментальных задач, является разновидностью контрольной работы и проводится несколько иначе, чем практическое занятие по инструкции. Подготовку учащихся к решению экспериментальных задач можно проводить поэтапно: 1. Сначала задача решается всем классом теоретически. Для этого необходимо проанализировать условие задачи, сформулировать вопросы, на которые нужно дать ответ для получения окончательного результата, предложить опыты, необходимые для ответа на каждый вопрос. 2. Один из учащихся решает задачу у доски теоретически. 3. Учащийся у доски выполняет эксперимент. После этого класс приступает к решению аналогичных задач на рабочих местах. Экспериментальные задачи целесообразно распределять по вариантам, чтобы добиться большей самостоятельности и активности в процессе работы. Практикум по химии Говоря об ученическом эксперименте, нельзя не упомянуть такой его вид, как практикум. Практикум в вузах, колледжах, средних специальных учебных заведениях является важ- 1 Беспалов П. И., Чернобельская Г. М.Химический эксперимент в малых группах // Химия в школе, 1991, № 5. С. 48—50. | |||||||||||
| 89. | нейшей формой обучения, и методика его организации детально разработана. Здесь практикумы, как правило, отлично методически обеспечены. Для них написаны специальные пособия, созданы лаборатории. Продолжительность занятий практикума колеблется от 3 до 6—7 часов. В школе же практикум организован несколько иначе. Химический практикум в школе — это целый комплекс практических работ, сгруппированных в единую систему занятий. Он уже давно привлекал внимание методистов. Исследованию методики организации химического практикума в средней школе посвятили в 60-е годы свои работы К. Я. Парменов, И. Т. Сыроежкин,1 в 70 — 80-е — Б. Н. Пасечник,2 а в конце 90-х г. — Т. С. Назарова, О. И. Качалова.3 При этом все подчеркивали важность создания для практикума специальной материальной базы. Практикум более уместен там, где есть специальное помещение, оборудованное именно для практикума. Но он может быть организован и в обычном химическом кабинете, если тот хорошо оснащен. В практикуме ученики выполняют целую серию практических работ в конце большого раздела курса химии, включающего несколько тем. Практикум не исключает текущих практических занятий и лабораторных опытов, в этом случае в нем предлагаются более сложные задания. В практикум могут включаться работы, требующие более длительного времени, использования дополнительной аппаратуры, количественных измерений, расчетов, построения графиков, так как предполагается, что для практикума отводится больше времени, организуются сдвоенные уроки. В практикум включаются и окспериментальные задачи, через которые устанавливается связь между темами. Некоторые учителя объединяют в практикум запланированные программой практические работы по темам. Другие считают, что для практикума должны быть отобраны специальные практические задания. Благодаря своему положению, практикум носит повторительно-обобщающий характер, а задания в нем требуют большей Самостоятельности и включают ученические исследования. По этой причине практикум проводится чаще в старших классах. 1 Парменов К. Я., Сыроежкин И. Т. Опрактикуме по химии в средней школе // Химияв школе, 1962, № 6.С. 25—31. 2 Пасечник Б. Н.Организация ученического эксперимента в школе // Химия К школе, 1986, № 4. С. 53—57. 8 Качалова О. И. Методические основы организации школьного практикума ПО общей химии (IIкласс): Канд. дисс. под рук. Т.С. Назаровой. — Омск, 1998. | |||||||||||
| 90. | Примером отбора экспериментальных работ для практикума по общей химии для 11 класса может служить разработка О. И. Качаловой и Т. С. Назаровой. Приведем фрагмент этого практикума: «...5. Определение теплоты растворения. 6. Определение химической активности кислот и сравнение со степенью их диссоциации. 7. Гидролиз солей. 8. Приготовление буферных растворов (смесей). 9. Получение комплексной соли. 10. Очистка твердого вещества перекристаллизацией.» и др. Для практикума должен быть написан комплект инструкций, включающих номер, тему и цель каждой работы, содержание самоподготовки (что повторить, как проверить свою готовность к работе), перечень оборудования, чертежи приборов, последовательность (алгоритм) действий, требования к отчету, вопросы для самопроверки. При выполнении работ практикума соблюдаются все требования, предъявляемые к проведению практических занятий, но может быть и по-другому. Например, группы столов в кабинете химии подготавливаются для разных работ. Тогда учащимся приходится меняться местами, чтобы выполнить все задания практикума. Такая организация работы сложнее, так как нужно выверить работы во времени, чтобы никому не пришлось ждать. В некоторых школах для практикума класс разделяется на две подгруппы, и это учитывается в расписании уроков. § 2.1.7. МЕТОДИКА ИСПОЛЬЗОВАНИЯ В ОБУЧЕНИИ ХИМИЧЕСКИХ ЗАДАЧ РОЛЬ ЗАДАЧ В ОБУЧЕНИИ ХИМИИ И ИХ КЛАССИФИКАЦИЯ Решение химических задач способствует осуществлению связи обучения с жизнью, воспитывает трудолюбие, целеустремленность, вырабатывает мировоззрение, так как в задачах легко реализуются межпредметные связи. Велика развивающая функция решения задач, которая формирует рациональные приемы мышления, устраняет формализм знаний, прививает навыки самоконтроля, развивает самостоятельность. Образовательная роль задач выражается в том, что, например, расчетные задачи раскрывают перед учащимися количественную сторону химии как точной науки. Через задачи осуществляется связь теории с практикой, в процессе их реше- | |||||||||||
| 91. | ния закрепляются и совершенствуются химические понятия о веществах и процессах. На основе решения задач, особенно ка-чественных, легко организовать проблемное обучение. Процесс решения задачи — это восхождение от абстрактного к конкретному. В методологическом аспекте — это переход от абстрактного мышления к практике, связь частного с общим. Необходимо помнить, что решение задач — это не самоцель, а средство обучения, способствующее прочному усвоению знаний. Классифицируют задачи по типам решений, в основном на качественные и расчетные.1 Качественные задачи по химии Среди широко известных типов качественных задач можно указать следующие: 1. Объяснение перечисленных или наблюдаемых явлений: почему реакция карбоната кальция с серной кислотой начинается сначала бурно, а затем прекращается? Почему при нагревании сухого карбоната аммония вещество исчезает из пробирки? 2. Характеристика конкретных веществ: с какими веществами и почему может реагировать соляная кислота? С какими из перечисленных веществ будет вступать в реакцию соляная кислота? 3. Распознавание веществ: в какой из пробирок находятся кислота, щелочь, соль? В какой из пробирок находятся соляная кислота, серная, азотная? 4. Доказательство качественного состава веществ: как доказать, что в состав хлорида аммония входят ион аммония и ион хлора? * 5. Разделение смесей и выделение чистых веществ: как очистить кислород от примеси оксида углерода (IV)? 6. Получение веществ: получить хлорид цинка всеми возможными способами. К этому же типу задач относят и цепочки превращений, а также получение вещества, если дан ряд других веществ как исходных. Могут быть задачи на применение прибора, например: указать, какой из приборов можно использовать для собирания аммиака, кислорода, водорода, хлора и т. д. (рис. 2.1.) Задачи решают устно, письменно или экспериментально. 1 Шаповаленко С. Г. Методика обучения химии. — М., 1963. | |||||||||||
| 92. | Расчетные задачи по химии Приобучении учащихся решению расчетных химических задач следует помнить, что решение задач — это не самоцель, это средство, способствующее более глубокому пониманию и усвоению химических понятий и в первую очередь количественных. Обычно у учащихся при решении расчетных химических задач возникают затруднения особого порядка, связанные именно со спецификой химической науки. Прежде всего они вызваны тем, что химические расчеты требуют использования особой физической величины, называемой «количество вещества» и ее единицы — моля. При этом важно учесть, что для понимания этой величины очень мало опорных понятий, что не способствует реализации принципа доступности. Эти абстрактные понятия труднодоступны для учащихся, так как они не имеют аналогии в других, предшествующих химии предметах. Кроме того, для непосредственного измерения определенного количества вещества нет соответствующих приборов. Можно измерить массу, объем, но не количество вещества в молях. Оно определяется опосредованно, расчетом. Поэтому учащимся VIII класса, у которых абстрактное мышление еще недостаточно хорошо развито, следует облегчить усвоение этого материала, по возможности привлекая наглядность, хотя и это очень трудно, потому что требует развитого воображения. Понятие «количества вещества» полезно объяснять, исходя из числа структурных частиц N, а «моль» — из числа Авогадро NA. Это переводит объяснение в конкретную плоскость. Вторая причина трудностей в том, что в химии при расчетах приходится оперировать двумя рядами формул — химическими и математическими. Все эти трудности необходимо преодолеть, показывая учащимся, что все без исключения химические расчеты основаны на использовании моля как единицы количества вещества. Ученики должны это твердо осознать. Конечно, легче объяснить расчет через составление пропорции в граммах или объемах. Эти величины давно знакомы учащимся так же, как и пропорции. Но если учитель пойдет по этому пути, он рискует в дальнейшем никогда не научить учащихся мыслить количественными химическими понятиями. Они не смогут объяснить причины, по которым можно составлять такие пропорции и будут считать использование понятия «моль» совершенно лишним и ненужным. Подбирать задачи нужно так, чтобы возникала необходимость использовать эту единицу. И лишь тогда, когда в созна- | |||||||||||
| 93. | 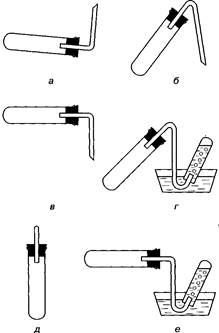 Рис. 2.1. Варианты конструкции прибора для получения газов
Рис. 2.1. Варианты конструкции прибора для получения газов
| |||||||||||
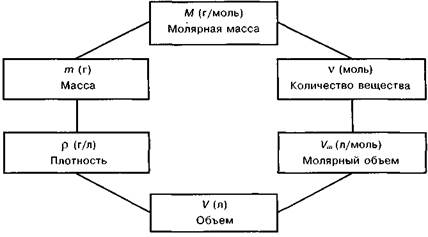
| 94. | нии учащихся утвердится, что количественные отношения веществ всегда выражаются в молях, можно учить переходным формулам, показать взаимосвязь массы и количества вещества, объема и количества вещества (см. схему 2.2.).
Схема 2.2 Схема взаимосвязи физических величин
 Еще одна трудность заключается в том, что иногда название величин вступает в противоречие с прежними, прочно утвердившимися понятиями учащихся. Например, величину «молярная масса» учащиеся воспринимают как массу, но размерность ее не грамм (как должно быть у массы), а «г/моль» (отношение массы к количеству вещества). Та же ситуация и с молярным объемом.
Очень важно правильно объяснить, что такое молярная масса М и что такое молярный объем У,„, показать их размерность и объяснить, как с их помощью осуществляется переход от массы и объема к количеству вещества и обратно. Нужно рассказать о постоянной Авогадро Л^д. Учащиеся должны всеми формулами пользоваться сознательно. Общие формулы всегда абстрактны, выражают обобщенные подходы к решению, а в каждой задаче они конкретизируются. Полезно довести до сведения учащихся схему, отражающую систему количественных понятий, связи между ними и переходные формулы, выражающие связи между этими понятиями.1
1 В Международной системе единиц используются в качестве единиц массы — килограмм (кг), объема — кубический метр (м3). В химии же разрешено пользоваться дольными единицами массы — граммом, объема — литром.
Еще одна трудность заключается в том, что иногда название величин вступает в противоречие с прежними, прочно утвердившимися понятиями учащихся. Например, величину «молярная масса» учащиеся воспринимают как массу, но размерность ее не грамм (как должно быть у массы), а «г/моль» (отношение массы к количеству вещества). Та же ситуация и с молярным объемом.
Очень важно правильно объяснить, что такое молярная масса М и что такое молярный объем У,„, показать их размерность и объяснить, как с их помощью осуществляется переход от массы и объема к количеству вещества и обратно. Нужно рассказать о постоянной Авогадро Л^д. Учащиеся должны всеми формулами пользоваться сознательно. Общие формулы всегда абстрактны, выражают обобщенные подходы к решению, а в каждой задаче они конкретизируются. Полезно довести до сведения учащихся схему, отражающую систему количественных понятий, связи между ними и переходные формулы, выражающие связи между этими понятиями.1
1 В Международной системе единиц используются в качестве единиц массы — килограмм (кг), объема — кубический метр (м3). В химии же разрешено пользоваться дольными единицами массы — граммом, объема — литром.
| |||||||||||
| 95. | 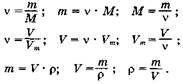 Для самоконтроля и для лучшего запоминания учителя иногда на первом этапе вывешивают настенную таблицу со схемой и формулами. Другие считают, что лучше, чтобы учащиеся всякий раз сами выводили эти формулы, но очевидно одно — учащиеся должны усваивать величины, «работающие» в формуле, сознательно.
Решение расчетных задач по химии очень тесно связано с физикой и математикой. Эти межпредметные связи надо постоянно иметь в виду.
В курсе физики величина «количество вещества» изучается значительно позднее, чем в химии. Поэтому важно правильно сформировать понятие о ней, чтобы в дальнейшем у учащихся не возникало противоречий.
Методику решения задач также полезно связать с физикой, сохраняя форму записи условия и решения. Этого требует и соблюдаемый в школе единый орфографический режим. Кроме того, гораздо более рационален физико-математический путь решения, когда все расчеты производят сначала в буквенных выражениях и лишь после этого подставляют числовые значения. Проиллюстрируем форму записи, например, на задаче:1
«В лаборатории чистое железо можно получить по реакции его оксида FеО с водородом при повышенной температуре. Составьте уравнение реакции (один из ее продуктов — вода) и рассчитайте необходимые количества оксида и водорода для получения 1 г железа».
Для самоконтроля и для лучшего запоминания учителя иногда на первом этапе вывешивают настенную таблицу со схемой и формулами. Другие считают, что лучше, чтобы учащиеся всякий раз сами выводили эти формулы, но очевидно одно — учащиеся должны усваивать величины, «работающие» в формуле, сознательно.
Решение расчетных задач по химии очень тесно связано с физикой и математикой. Эти межпредметные связи надо постоянно иметь в виду.
В курсе физики величина «количество вещества» изучается значительно позднее, чем в химии. Поэтому важно правильно сформировать понятие о ней, чтобы в дальнейшем у учащихся не возникало противоречий.
Методику решения задач также полезно связать с физикой, сохраняя форму записи условия и решения. Этого требует и соблюдаемый в школе единый орфографический режим. Кроме того, гораздо более рационален физико-математический путь решения, когда все расчеты производят сначала в буквенных выражениях и лишь после этого подставляют числовые значения. Проиллюстрируем форму записи, например, на задаче:1
«В лаборатории чистое железо можно получить по реакции его оксида FеО с водородом при повышенной температуре. Составьте уравнение реакции (один из ее продуктов — вода) и рассчитайте необходимые количества оксида и водорода для получения 1 г железа».
 1 Гузей Л. С, Сорокин В. В., Суровцева Р. П.Химия. 8 класс. — М.: Дрофа, 1955. С. 68.
1 Гузей Л. С, Сорокин В. В., Суровцева Р. П.Химия. 8 класс. — М.: Дрофа, 1955. С. 68.
| |||||||||||
| 96. | Ответ: Для получения 1 г железа требуется 0,18 моль водорода и 0,18 моль оксида железа. Набор расчетных задач в школьном курсе химии невелик. Различают обычно расчеты по формулам и расчеты по уравнениям реакций. Особо выделяют задачи, связанные с растворами. В некоторых программах оговорено, в каких темах какие типы задач следует вводить, в других право выбора предоставляется учителю. Поэтому приведем только перечень типов задач, решение которых учащиеся осваивают в школе. А. Расчеты по формулам: — Вычисление относительной молекулярной массы вещества. — Вычисление отношения масс атомов элементов в сложном веществе. — Вычисление массовой доли элемента в веществе (в %). — Вычисление массы определенного количества вещества. — Вычисление масс и объемов газов (при н. у.). — Вычисление относительной плотности газов. Б. Расчеты по уравнениям — Вычисление масс веществ или объемов газов по известному количеству вещества одного из вступающих в реакцию или образующихся в результате ее веществ. — Вычисление объемных отношений газов по химическим уравнениям. — Расчет по термохимическим уравнениям количества теплоты по известному количеству и массе одного из участвующих в реакции веществ. — Расчеты по химическим уравнениям, если одно из реагирующих веществ дано в избытке. — Определение массовой доли выхода продукта от теоретически возможного. — Вычисление массы продукта реакции по известной массе исходного вещества, содержащего определенную массовую долю примесей. В. Расчеты на выведение формул веществ Нахождение молекулярной формулы газообразного вещества на основании его плотности и массовых долей входящих в него элементов (в %). Г. Расчеты массовой доли вещества в растворе (в %) Расчеты по определению массовой доли растворенного вещества (в %) в растворе и массы растворенного вещества по известной массовой доле его в растворе. | |||||||||||
| 97. | Обучение учащихся решению расчетных химических задач следует начинать постепенно. Сначала научить подсчитывать относительную молекулярную массу Мr, постепенно переходить к молярной массе М (г/моль), затем к решению задач по химической формуле веществ и затем к расчетам по химическим уравнениям. При этом вначале расчеты не следует усложнять. Начинают их производить обязательно в молях, подбирая условия так, чтобы не требовалось перевода в граммы или литры. Впоследствии такой перевод будет казаться вполне естественным. Конечно, содержание задач обязательно должно быть согласовано с изучаемой темой. Нельзя, например, требовать расчета объема газа, если еще неизвестен закон Авогадро и молярный объем. И только после всего этого допустимы всевозможные усложнения задач и их комбинирование, широко используемые для составления олимпиадных и конкурсных задач. Нередко при решении задач приходится видеть скучающие глаза учеников, которые считают, что химические расчеты вовсе не нужны. Тогда учитель привлекает для обоснования их необходимости по возможности жизненные примеры. Можно задать на дом выполнение какого-нибудь домашнего опыта, связав его с расчетом. О едином методическом подходе к решению задач по химии В решении задач должен соблюдаться единый методический подход. Ведущая роль в обучении учащихся решению задач принадлежит учителю. Но нельзя недооценивать и самостоятельности учащихся при решении задач. При переходе от одного этапа к другому следует руководствоваться рекомендациями по формированию умений. Рассмотрим сущность этих этапов. Выбирая задачу для учащихся, учитель обязан оценить ее с точки зрения следующих целей. 1. Какие понятия, законы, теории, факты должны быть закреплены в процессе решения, какие стороны свойств изучаемого вещества и химические реакции отмечены в процессе решения. 2. Какие приемы решения задачи должны быть сформированы. 3. Какие мыслительные приемы развиваются в процессе решения задачи. 4. Какие дидактические функции выполняют данные задачи. Если учитель ставит перед собой цель — закрепление тео- | |||||||||||
| 98. | ретического материала, то метод решения задачи должен быть уже известен учащимся. Если учитель хочет объяснить новый тип задачи по методу решения, то учащиеся должны свободно оперировать учебным материалом. Одновременно обе цели ставить не рекомендуется. Задачу учитель решает заранее и проверяет ответ, чтобы убедиться, что он правильный. На уроке в классе учитель актуализирует знания учащихся, которые используются при решении задачи. Затем проводится анализ условия задачи. Учитель кратко его записывает с помощью символов и условных обозначений, как уже было показано выше. Далее разрабатывают план решения и по возможности выражают его в общем виде с помощью указанных выше формул, соблюдая все правила, которым учащиеся обучены на уроках математики и физики. Только после этого приступают к числовому решению и проверяют ответ. Если цель решения — изучение нового типа задач, то четко формулируют алгоритм, который учащиеся записывают в тетрадь, и отмечают, какому типу решения он соответствует. В младших классах алгоритм может быть выражен в виде вопросов задачи. После этого к доске можно вызвать хорошего ученика, чтобы он решил аналогичную задачу. Далее учащимся предлагают самостоятельно решить аналогичную задачу. Задачи различают сложные и трудные. Сложными называют задачи, которые требуют от ученика применения теоретических знаний по разным темам курса химии, умения решать задачи разных типов, объединяя и выбирая для решения конкретной задачи все необходимое. Нередко это задачи обобщающие. Сложность задачи — понятие объективное, подразумевающее большое число элементов знаний и умений, используемых при их решении и определенного перечня мыслительных операций. Трудные задачи — понятие субъективное. Имеются в виду задачи, требующие творческого подхода, неожиданных умственных действий. Их следует давать для самостоятельного решения только сильным учащимся. В классе такую задачу объяснять не следует. Ее можно использовать в виде индивидуального задания или на внеклассных занятиях. Впрочем, для учеников со слабой обучаемостью трудной задачей может оказаться и объективно сравнительно простая. Учитель обязан это учитывать, осуществляя индивидуальный подход, который при решении задач особенно уместен. При решении | |||||||||||
| 99. | задач развивающая функция обучения проявляется особенно четко. С их помощью можно добиться повышения уровня мыслительной активности учеников. В настоящее время издается очень большое число сборников задач, что предоставляет учителю широкий выбор. ВЫВОД Методы обучения химии — сложная категория; через них устанавливается связь между химическим содержанием и процессом его усвоения учащимися. Методы и содержание образуют диалектическое единство, так как любое содержание вводится в учебный процесс посредством метода. По отношению к учащимся методы обучения — это методы учебного познания. Усваивая содержание, ученик воспринимает и метод его изучения, который может быть в дальнейшем применен и по отношению к другому содержанию. Методы обучения имеют сложную структуру, в основе которой лежит единство преподавания и учения, направленное на реализацию образовательной, воспитывающей и развивающей функций обучения. Выбор методов обучения осуществляется учителем и зависит от многих факторов. Многочисленные попытки классифицировать методы обучения показывают, что в дидактике и методике обучения химии этот вопрос не имеет еще однозначного решения в силу своей сложности. Широко известна классификация методов: 1) по характеру познавательной деятельности учащихся (общие методы): объяснительно-иллюстративный, репродуктивный, эвристические и исследовательский, различающиеся по степени познавательной активности и самостоятельности обучаемых; 2) по дидактической цели: методы изучения нового материала, закрепления и совершенствования и контроля знаний и умений учащихся; 3) по источнику знаний: словесные, словесно-наглядные и словесно-наглядно-практические. Названия последних говорят о том, что любые из них предполагают прежде всего использование слова как источника знаний самого по себе или в сочетании с химическим экспериментом, средствами наглядности и объектами практической деятельности учащихся. | |||||||||||
| 100. | Использование химического эксперимента в обучении химии в наибольшей степени отражает специфику предмета химии. В виде демонстрационных опытов химический эксперимент относится к словесно-наглядным методам обучения, в виде лабораторных и практических занятий — к словесно-наглядно-практическим. Задача школьного эксперимента — ознакомление учащихся с проявлением химических процессов, свойствами веществ и методами химической науки. В методике разработаны требования к разным видам химического эксперимента. Использование словесно-наглядных методов обучения возможно только при наличии необходимых средств наглядности. Важнейшим словесно-наглядным методом обучения является использование демонстрационного химического эксперимента, которое должно быть подчинено определенным методическим правилам и осуществляться в сочетании со словом учителя и другими средствами наглядности, например, с записью на доске, таблицами, моделями, экранными пособиями и т. д. В этих условиях особенно ярко проявляется образовательная, воспитывающая и развивающая функции учебного процесса. ВОПРОСЫ И ЗАДАНИЯ 1. Раскройте сущность дидактического единства содержания и методов обучения. 2. В каком соотношении находятся методы обучения с методами познания и методами химической науки? Приведите конкретные примеры. 3. Какие критерии лежат в основе классификаций методов обучения7 4. Какие факторы определяют выбор метода обучения? 5. Найдите в учебнике химии материал, который можно сообщить методами описания, объяснения, рассказа. Обоснуйте ответ. Постройте объяснение и рассказ иллюстративно и проблемно. 6. Найдите в учебнике химии для учащихся IX класса материал, который можно сообщить методом лекции. Обоснуйте свой выбор. 7. Какой учебный эксперимент по химии следует называть демонстрационным? 8. Каковы требования к демонстрационному эксперименту по химии? 9. На примере возгонки йода покажите разные способы сочетания демонстрационного эксперимента со словом учителя. 10. Из программы по химии выпишите названия демонстрационных опытов по химии и укажите, какие требования техники безопасности нужно обеспечить при выполнении каждого из них. | |||||||||||
| 101. | 11. Сопоставьте использование классной доски и графопроектора. В чем преимущества того и другого средства наглядности? 12. Какие виды ученического эксперимента известны? Чем они отличаются друг от друга? Всегда ли ученический эксперимент эффективнее демонстрационного? Обоснуйте свой ответ. 13. В чем различие по дидактической цели практической работы по инструкции и экспериментального решения задач? 14. Руководствуясь условиями экспериментальных задач по теме «Теория электролитической диссоциации», составьте варианты заданий (не менее четырех) для практического занятия по экспериментальному решению задач. Обоснуйте их и составьте перечень необходимого оборудования для их решения. 15. Изучите содержание практических работ курса химии IX класса и определите, какие экспериментальные умения необходимы для их выполнения. Какие из этих умений закладываются ранее и где? Какие новые умения формируются в IX классе? В какой теме? 16. Разработайте для прокторов лист учета экспериментальных умений по любой практической работе. 17. Составьте примеры качественных задач каждого типа. 18. Составьте или найдите в задачнике расчетные задачи каждого типа. 19. Дана следующая задача: отходящие газы содержат много оксида серы (IV). Так, при получении из сульфидных руд 1 т черновой меди выделяется одновременно 7,3 т оксида серы (IV). Вычислите, сколько 75%-ной серной кислоты может быть получено из оксида серы (IV), выделившегося при выплавке 1000 т черновой меди. Установите место этой задачи в курсе химии средней школы. Какие знания необходимы для ее решения? Какие варианты решения этой задачи могут предложить учащиеся и какой из них наиболее рациональный? Какие типы школьных задач сочетаются в этой задаче? ТЕМЫ ДЛЯ РЕФЕРАТОВ 1. Взаимосвязь методов обучения химии с методами химической науки. 2. Реализация через методы обучения межпредметных связей химии с биологией (физикой, математикой и др.). 3. Методика проведения обобщения на уроках химии. 4. Методика использования на уроке рассказа-задачи по химии. 5. Сочетание демонстрационного эксперимента по химии с другими средствами наглядности. 6. Использование наглядности при решении расчетных задач по химии. 7. Методика обучения учащихся решению задач с недостающими и избыточными данными. 8. Методы изучения количественных понятий в химии. | |||||||||||
| 102. | Литература по теме
1. Абкин Г. П.Методика решения задач по химии. — М.: Просвещение, 1971.
2. Аркавенко Л. Н., Гапонцев В. Л., Белоусова О. А.Для чего классифицировать расчетные задачи // Химия в школе, 1995, № 3. С. 60.
3. Архангельская О. В.Решение задач. Чем проще, те
|




