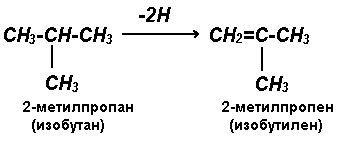Тема занятия поКТП №34 Алкены. Этилен. Строение и свойства
Цель Сформировать понятие о непредельных углеводородах (алкенах). Познакомить студентов со строением и свойствами алкенов на примере этилена Систематизировать и обобщить знания о придельных углеводородах и дать сравнительную характеристику алканов и алкенов. Развивать умение сравнивать обобщать и устанавливать причинно- следственную связь между строением и свойствами веществ Общие сведения
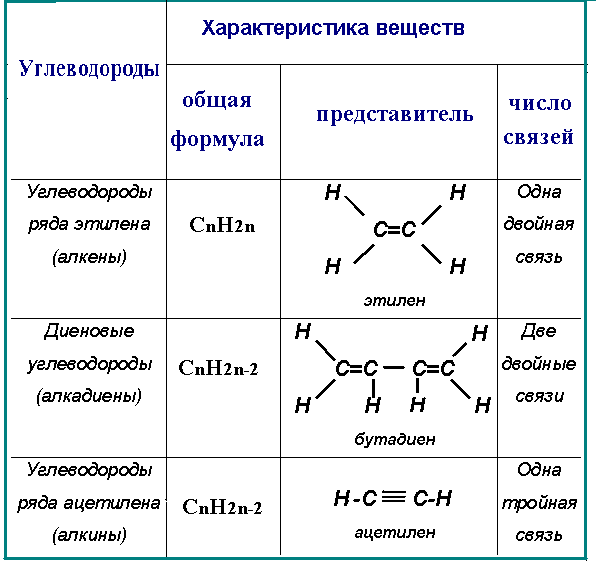
Этилен. Гомологи этилена Углеводороды с общей формулой СnH2n, в молекулах которых между атомами углерода имеется одна двойная связь, называются углеводородами ряда этилена, или алкенами. Изомерия и номенклатура Формулы углеводородов ряда этилена можно вывести из соответствующих формул предельных углеводородов. Названия углеводородов ряда этилена образуют путем изменения суффикса -АН соответствующего предельного углеводорода на
У углеводородов ряда этилена изомерия проявляется не только в строении углеродного скелета, как у предельных углеводородов, но и в положении двойной связи в молекуле. Так, например, от формулы нормального бутана можно вывести формулы двух непредельных изомеров. Чтобы их назвать, атомы углерода нумеруют, начиная с того конца цепи, к которому ближе двойная связь. Положение двойной связи обозначают в начале названия номером того углеродного атома, от которого она начинается:
От формулы 2-метилпропана (изобутана) можно вывести формулу одного непредельного изомера:
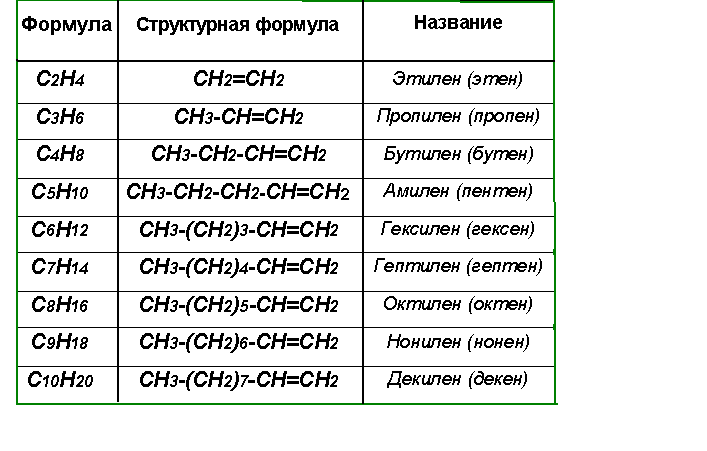
Гомологический ряд этиленовых углеводородов
Физические свойства Этилен - бесцветный газ, почти без запаха, немного легче воздуха, плохо растворим в воде. Пропен и бутены (бутилены) при нормальных условиях также газообразны, от пентена С5H10 до октадецена С18H36 включительно углеводороды находятся в жидком состоянии, а начиная с нонадецена С19H38-в твёрдом. Химические свойства Химические свойства определяются наличием в их молекулах двойной связи. Для них характерны реакции присоединения, окисления и полимеризации.
В присутствии серной и ортофосфорной кислоты этилен присоединяет воду (реакция гидратации):
Этилен и его гомологи присоединяют также галогеноводороды:
Пропилен и последующие углеводороды ряда этилена реагируют с галогеноводородами согласно правилу В.В.Марковникова. Водород присоединяется к наиболее, а атом галогена - к наименее гидрированному атому углерода:
Этилен и его гомологи способны гореть в воздухе:
Этилен и его гомологи легко окисляются:
Процесс соединения многих одинаковых молекул в более крупные называется реакцией полимеризации.
Способы получения 1. Этилен в лаборатории получают при нагревании смеси этилового спирта с концентрированной серной кислотой:
2. Углеводороды ряда этилена можно получить также дегидрированием предельных углеводородов:
3. На производстве этилен получают из природного газа при процессах крекинга и пиролиза нефти. 4. Углеводороды ряда этилена можно получить при взаимодействии дигалогенопроизводных предельных углеводородов с металлами:
Применение 1 Получение горючего с высоким октановым числом,
Вопросы для самоконтроля
1.Дайте определение и назовите общую формулу алкенов 2.Запишите молекулярную и структурную формулу этилена 3..Назовите способы получения алкенов 4.Охарактеризуйте физические свойства алкенов 5.Запишите уравнения охарактеризующие химические свойства алкенов на примере пропена 6.Назовите области применения алкенов
|