Электронное строение гомоядерных двухатомных молекул и ионов
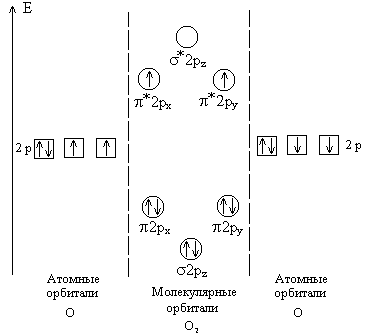
Процесс образования частицы H2+ можно представить следующим образом: Н[1s] + Н+ Таким образом, на связывающей молекулярной s -орбитали располагается один электрон. Кратность связи равна полуразности числа электронов на связывающих и разрыхляющих орбиталях. Значит, кратность связи в частице H2+ равна (1 – 0):2 = 0,5. Метод ВС, в отличие от метода МО, не объясняет возможность образования связи одним электроном. Молекула водорода имеет следующую электронную конфигурацию: H2[(s 1s)2]. В молекуле H2 имеется два связывающих электрона, значит, связь в молекуле одинарная. Молекулярный ион H2- имеет электронную конфигурацию: H2- [(s 1s)2(s *1s)1]. Кратность связи в H2- составляет (2 – 1):2 = 0,5. Рассмотрим теперь гомоядерные молекулы и ионы второго периода. Электронная конфигурация молекулы Li2 следующая: 2Li (K2s) Молекула Li2 содержит два связывающих электрона, что соответствует одинарной связи. Процесс образования молекулы Ве2 можно представить следующим образом: 2 Ве(K2s2) Число связывающих и разрыхляющих электронов в молекуле Ве2 одинаково, а поскольку один разрыхляющий электрон уничтожает действие одного связывающего, то молекула Ве2 в основном состоянии не обнаружена. В молекуле азота на орбиталях располагаются 10 валентных электронов. Электронное строение молекулы N2: N2 [KK*(s 2s)2 (s *2s)2 (p2px)2 (p2py)2 (s 2pz)2]. Поскольку в молекуле N2 восемь связывающих и два разрыхляющих электрона, то в данной молекуле имеется тройная связь. Молекула азота обладает диамагнитными свойствами, поскольку не содержит неспаренных электронов. На орбиталях молекулы O2 распределены 12 валентных электронов, следовательно, эта молекула имеет конфигурацию: O2 [KK*(s 2s)2 (s *2s)2 (s 2pz)2 (p2px)2 (p2py)2 (p*2px)1 (p*2py)1].
Рис. 9.2. Схема образования молекулярных орбиталей в молекуле О2 (показаны только 2р-электроны атомов кислорода) В молекуле O2, в соответствии с правилом Хунда, два электрона с параллельными спинами размещаются по одному на двух орбиталях с одинаковой энергией (рис. 9.2). Молекула кислорода по методу ВС не имеет неспаренных электронов и должна обладать диамагнитными свойствами, что не согласуется с экспериментальными данными. Метод молекулярных орбиталей подтверждает парамагнитные свойства кислорода, которые обусловлены наличием в молекуле кислорода двух неспаренных электронов. Кратность связи в молекуле кислорода равна (8–4):2 = 2. Рассмотрим электронное строение ионов O2+ и O2-. В ионе O2+ на его орбиталях размещаются 11 электронов, следовательно, конфигурация иона следующая: O2+[KK*(s 2s)2 (s *2s)2 (s 2pz)2 (p2px)2 (p2py)2 (p*2px)1] или O2+[KK*(s 2s)2 (s *2s)2 (s 2pz)2 (p2px)2 (p2py)2 (p*2py)1]. Кратность связи в ионе О2+ равна (8–3):2 = 2,5. В ионе O2- на его орбиталях распределены 13 электронов. Этот ион имеет следующее строение: O2- [KK*(s 2s)2 (s *2s)2 (s 2pz)2 (p2px)2 (p2py)2 (p*2px)2 (p*2py)1] или O2- [KK*(s 2s)2 (s *2s)2 (s 2pz)2 (p2px)2 (p2py)2 (p*2px)1 (p*2py)2]. Кратность связи в ионе О2- равна (8 – 5):2 = 1,5. Ионы О2- и О2+ являются парамагнитными, так как содержат неспаренные электроны. Электронная конфигурация молекулы F2 имеет вид: F2 [KK(s 2s)2 (s *2s)2 (s 2pz)2 (p2px)2 (p2py)2 (p*2px)2 (p*2py)2]. Кратность связи в молекуле F2 равна 1, так как имеется избыток двух связывающих электронов. Поскольку в молекуле нет неспаренных электронов, она диамагнитна. В ряду N2, O2, F2 энергии и длины связей в молекулах составляют:
Увеличение избытка связывающих электронов приводит к росту энергии связи (прочности связи). При переходе от N2 к F2 длина связи возрастает, что обусловлено ослаблением связи. В ряду О2-, О2, О2+ кратность связи увеличивается, энергия связи также повышается, длина связи уменьшается.
|

 H2+[s 1s].
H2+[s 1s].