Вторичная структура
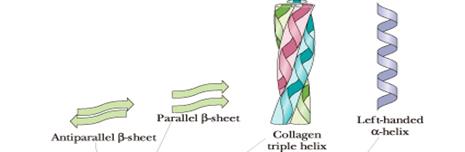
Вначале многие фрагменты пептидной цепи приобретают периодическую укладку того или иного типа: a-спираль, β-структуру (рис. 2-5) или коллагеновую спираль. Этот низший уровень пространственной организации называется вторичной структурой.
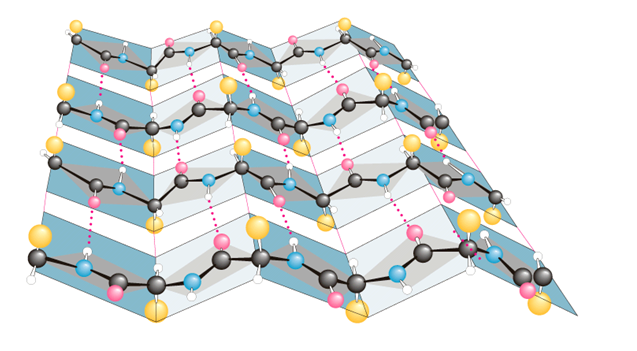
Рис. 2. типы вторичной структуры белка a-Спиралъ. Здесь остов пептидной цепи закручивается в спираль — так, что радикалы аминокислот обращены кнаружи от спирали.
Рис. 3. α-спираль - Эта структура удерживается водородными связями между остовами аминокислот. Более точно, в образовании одной такой связи участвуют группа —NH— одной аминокислоты и группа —CO— другой аминокислоты, которая в пептидной цепи отделена от первой тремя другими аминокислотами. В итоге на один виток а-спирали приходится в среднем 3,6 аминокислотных остатков β-Складчатая структура. Здесь остовы пептидных цепей не скручены в спираль, а имеют зигзагообразную конфигурацию (структура складчатого листа). Такая структура тоже удерживается водородными связями и между теми же группами (—NH— и —CO—). Ho теперь (если речь идет о глобулярном белке) для сближения этих групп и об разования связей пептидная цепь образует складки.
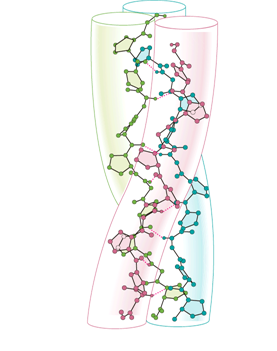
Рис. 4. β-складчатая структура Т. е. имеется двойная складчатость: - во-первых, крупные складки в результате поворота цепи на 180°, - во-вторых, мелкие изгибы цепи в пределах одной складки. Прилежащие друг к другу участки цепи в -структуре могут быть как параллельными (идти в одном направлении), так и антипараллельными. Коллагеновая спираль. Молекула коллагена представляет собой правозакрученную спираль из трёх цепей. Один виток спирали содержит три аминокислотных остатка. Все три спирали оплетают друг друга, образуя правозакрученную суперспираль; таким образом, окончательная структура представляет собою жгутоподобный стержень. Наличие глицина в каждом третьем положении повторяющейся последовательности -Gly-X-Y-является существенным, поскольку большая по размеру аминокислота не сможет стоять в центре тройной спирали, в месте схождения трех полипептидных цепей. Пролин часто присутствует в положении "X" последовательности -Gly-X-Y-, а гидроксипролин - в положении "Y".
Рис. 5. Коллагеновая структура Указанные аминокислотные остатки ограничивают вращение полипептидной спирали. Тройная спираль стабилизируется водородными связями и водными мостиками. Тройная спираль представляет собою относительно жесткую структуру. В некоторых случаях сопротивление молекулы растяжению или сжатию является важным для осуществления биологической функции белка. Во многих коллагенах тройная спираль прерывается глобулярными последовательностями, придающими белку большую гибкость. В одной и той же молекуле глобулярного белка могут встречаться разные виды вторичной структуры, а также и бесструктурные участки (лишенные какой либо вторичной структуры). Соотношение между ними в разных белках различно. Вторичная определяется первичной структурой белка или рассматриваемого фрагмента. Иными словами, боковые радикалы аминокислот, хотя непосредственно и не участвуют в стабилизирующих эту структуру связях, тем не менее определяют, каким образом пептидная цепь может свернуться для образования таких связей и может ли свернуться вообще. Так, например, остатки пролина гидроксипролина полностью исключают образование в своем локусе как а-спирали, так и β-структуры. Отсюда и получается типичное для каждого белка распределение между разными типами вторичной структуры
|