Полученные на опыте
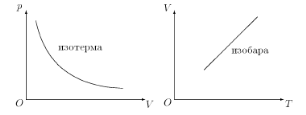
Количественная зависимость давленияр, температурыТ, объемаV и количества вещества ν друг от друга имеет самую простую форму для газа, особенно для газа, давление которого не очень велико (р ≈ 1 атм.) и температура не очень низка. Опыт показывает: главное свойство газов, отличающее их от жидкостей и твердых тел, состоит в способности газов к неограниченному расширению. Как бы ни был велик объем «вместилища», газ оказывает давление на все стенки одинаково. Этот закон называется законом Паскаля. Газ исследуют в условиях, когда два параметра постоянны (не меняются), а изменяются только два оставшихся. Первый газовый закон: для данной массы газа во сколько раз уменьшается объем, во сколько же раз увеличивается давление, был установлен еще в XVII веке англичанином Робертом Бойлем. Бойль был богатейшим предпринимателем, одним из президентов Ост-индской компании. Для опытов, которые заключались в том, что в герметическом сосуде — сосуде, не пропускающем газ (создать герметичность было очень трудно), — сжимался газ, Бойль не поскупился и купил бочку ртути, ведь давление увеличивали, подливая на поршень ртуть. В наши дни такие затраты соответствовали бы затратам на атомный ледокол. В дни Бойля понятие о температуре (казалось бы, такое естественное) не существовало, не было термометров (больным определяли «жар» наложением руки). Поэтому несколько десятилетий спустя другой ученый по фамилии Мариотт (аббат Эдмон Мариотт) переформулировал закон в форму, сохранившуюся до сих пор: произведение давления данной массы газа на его объем постоянно, если температура газа не изменяется. Или pV = const; T = const; ν = const. (1.4) Для двух состояний с параметрами р 1, V 1, T 1, ν1и р 2, V 2, T 2, ν2запишем p 1 V 1 = p 2 V 2; T 1 = T 2; ν1 = ν2. (1.5) Это означает, что рассматриваются два состояния одного и того же количества одного и того же газа при одной и той же температуре. Процессизменения состояния системы при постоянной температуре называют, как известно, изотермическим. Закон Бойля–Мариотта — это закон изотермического процесса в газе. Графически зависимость давления газа от объема изображается кривой и называется изотермой (рис. 1.1). Согласно закону Бойля–Мариотта изотерма газа изображает обратно пропорциональную зависимость между давлением и объемом. Кривую такого вида называют, как известно, гиперболой.
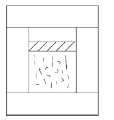
Рис. 1.1. Изотерма и изобара Итак, закон Бойля–Мариотта устанавливает зависимость между параметрами р и V при неизменных Т и ν. Другой закон устанавливает зависимость между V и Т при постоянных р и ν. Всем известно, что процессизменения состояния системы при постоянном давлении называется изобарным (см. рис. 1.1). Также как и для изотермического процесса, зависимость между параметрами V и Т при изобарном процессе можно установить на опыте, наблюдая изменение объема газа в цилиндре (рис. 1.2).
Рис. 1.2. Цилиндр — термостат (разрез) Цилиндр имеет вертикальные стенки, а сверху закрыт тяжелым поршнем, способным перемещаться с очень малым трением. Действующие на поршень сила тяжести тg, сила атмосферного давленияр 0, т. е. p 0 S, где S — площадь поршня, и дополнительная возможная сила F (например, сила тяжести налитой сверху высотой h ртути плотностью ρ) определяют давление р в газе под поршнем. Имеем:
Температура газа в цилиндре определяется окружающей системой и может либо оставаться постоянной (изотермические условия), либо медленно изменяться, оставаясь в тепловом равновесии с цилиндром. Такая система называется термостатом. Очевидно, что молекулы из термостата не могут выйти, а молекулы из окружающей термостат среды не могут в него попасть. Такие системы называют замкнутыми. Наблюдения показывают, что объем газа при постоянном давлении увеличивается линейно с повышением температуры. Если объем газа при 0 °С обозначить V 0, то
Величина α называется термическим коэффициентом объемного расширения. Такие линейные зависимости встречаются очень часто (вспомните закон Гука) и вообще должны быть всегда верны в небольшом диапазоне изменения переменных. Это как дифференциал функции — пропорционален приращению независимой переменной. Удивительным оказалось то, что величина α = 1/273 К–1для всех газов (любых химических составов) одинакова. Подставляя это значение в записанную выше формулу, получим:
Вот откуда происходит это магическое число «273». Итак:
или
Отношение объема данной массы газа к его температуре постоянно, если давление газа не изменяется. Это закон Гей-Люссака (один человек — Жозеф Луи Гей-Люссак) — закон изобарного (иногда говорят «изобарического») процесса в газе. Следующий закон (закон Авогадро) устанавливает, что при постоянных (одинаковых) давлении р = const и температуре Т = const одинаковые объемы газа (любого) содержат одно и то же количество вещества.
или
Именно этот закон позволил установить, что если взять массу вещества в граммах, численно равную массе атома в атомных единицах массы (1 моль), то любой (это главное — любой!) газ займет VМ = 22,4 л, при р 0 = 1 атм. и Т 0 = 273 К. Затем уже установили, что в одном моле N A = 6 ⋅ 1023 моль–1молекул. Такие значения параметров соответствуют так называемым нормальным условиям. Наконец, последний нужный нам экспериментальный закон — закон Дальтона. Дальтон установил, что давление смеси газов p = p 1 + p 2 + p 3 +... (1.13) равно сумме давлений, которые имел бы каждый из газов смеси, если удалить все остальные. Такое давление каждого газа (при удалении всех остальных) называется парциальным (собственным). Отметим, что при получении записанных выше законов представления о молекулярном строении вещества (газа) никак не использовались.
|

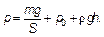 (1.6)
(1.6)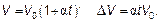 (1.7)
(1.7)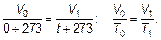 (1.8)
(1.8)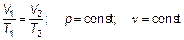 (1.9)
(1.9)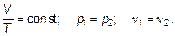 (1.10)
(1.10)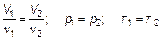 (1.11)
(1.11)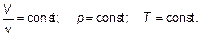 (1.12)
(1.12)


