Изотерма реального газа. Критическая температура
Чтобы проверить соответствие приведенных закономерностей фактической зависимости давления реального газа от его объема, взяли некоторую массу реального газа (или пара) при низком давлении и стали его сжимать, измеряя давление, соответствующее каждому объему сжимаемого газа, а затем построили по полученным значениям зависимость р(V). Получили график, изображенный на рис. Мы видим, что изотерма реального газа лишь на участках 1-2 и 6-7 совпадает с изотермой Ван-дер-Ваальса, показанной выше, а на остальных участках графика теория не соответствует опыту.
Однако, если газ или пар очистить от пылинок, заряженных частиц и примесей, которые могут стать центрами конденсации, то, быстро сжимая его без встряхивания, можно реализовать участок 2-3, изображенный штриховой линией. Такое состояние газа неустойчивое, поэтому его называют метастабилъным. Малейшее встряхивание или толчок в стенку сосуда с газом или паром приведет к быстрой конденсации. Если в такой пар (он называется пересыщенным) влетит заряженная частица, то по ее следу образуются крошечные капельки жидкости - трек частицы. Если жидкость, очищенную от примесей, которые могут стать центрами парообразования, взять в состоянии, изображенном точкой 6, и быстро, не встряхивая, нагреть, то можно осуществить участок 6-5, на котором она останется только жидкостью без образования насыщенного пара над ней. Такая жидкость называется перегретой. Состояние перегретой жидкости тоже является метастабильным, т. е. неустойчивым, малейшее встряхивание ведет к ее бурному вскипанию и появлению насыщенного пара.
При повышении температуры одновременно увеличиваются и давление насыщенного пара, и его плотность. При этом плотность жидкости, находящейся в динамическом равновесии со своим паром, уменьшается. На рис. изображен график зависимости от температуры плотности жидкости (верхняя кривая) и плотности насыщенного пара (нижняя кривая). При некоторой температуре Тк обе эти кривые сходятся в одну точку, т. е. плотности жидкости и пара становятся одинаковыми (при этом плотность жидкости минимальна, а плотность насыщенного пара максимальна). У каждого вещества имеется своя критическая температура (например, для воды 374°С, кислорода -118°С, водорода -240°С, гелия -268 °С).
|

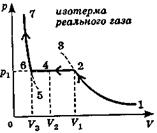 Когда давление газа мало, а его объем велик (точка 1), сжимаемый газ ведет себя подобно идеальному (участок 1-2 графика). Как и у идеального газа, графиком 1-2 является гипербола. Но, когда газ (пар) оказывается сжатым до объема V1 он переходит в состояние, которое называют насыщением, а сам газ или пар насыщенным паром. При дальнейшем сжатии уже насыщенного пара его давление р1 остается неизменным (участок 2-4-6). При сжатии насыщенного пара он постепенно конденсируется, т. е. переходит в жидкое состояние, причем так, что давление оставшегося над этой жидкостью насыщенного пара не изменяется, поэтому изотерма 2-4-6 идет параллельно оси объемов. Когда насыщенный пар будет сжат так, что его объем станет равен V3, он весь превратится в жидкость (точка 6). Дальнейшая попытка сжать эту жидкость приведет к резкому росту давления (участок 6-7). Это объясняется тем, что жидкости практически несжимаемы, поэтому участок 6-7 идет почти параллельно оси давлений.
Когда давление газа мало, а его объем велик (точка 1), сжимаемый газ ведет себя подобно идеальному (участок 1-2 графика). Как и у идеального газа, графиком 1-2 является гипербола. Но, когда газ (пар) оказывается сжатым до объема V1 он переходит в состояние, которое называют насыщением, а сам газ или пар насыщенным паром. При дальнейшем сжатии уже насыщенного пара его давление р1 остается неизменным (участок 2-4-6). При сжатии насыщенного пара он постепенно конденсируется, т. е. переходит в жидкое состояние, причем так, что давление оставшегося над этой жидкостью насыщенного пара не изменяется, поэтому изотерма 2-4-6 идет параллельно оси объемов. Когда насыщенный пар будет сжат так, что его объем станет равен V3, он весь превратится в жидкость (точка 6). Дальнейшая попытка сжать эту жидкость приведет к резкому росту давления (участок 6-7). Это объясняется тем, что жидкости практически несжимаемы, поэтому участок 6-7 идет почти параллельно оси давлений. Участок 3-4-5 нельзя реализовать никак, поскольку нельзя, сжимая газ изотермически, получить уменьшение его давления, это не имеет смысла.
Участок 3-4-5 нельзя реализовать никак, поскольку нельзя, сжимая газ изотермически, получить уменьшение его давления, это не имеет смысла. Если брать газ или пар в состоянии 1 при все более высоких температурах Т1 Т2, Т3, и т. д., то изотермы реального газа будут все дальше отходить от осей координат p-V и горизонтальный участок на них будет уменьшаться. При некоторой, достаточно высокой, температуре которая называется критической температурой Ткр горизонтальный участок изотермы исчезнет, превратившись в точку К. Состояние изображаемое этой точкой, называется критическим состоянием вещества. В критическом состоянии исчезает различие между жидкостью и паром: жидкость непрерывно переходит в пар, а пар - в жидкость. На рис. штриховой куполообразной кривой ограничена область двухфазного состояния вещества, т. е. когда одновременно существуют и жидкость и ее насыщенный пар. При температуре выше критической никаким сжатием пар нельзя перевести в жидкость, поскольку при критической температуре исчезают силы сцепления между молекулами и вещество остается в газообразном состоянии при любых давлениях и объемах.
Если брать газ или пар в состоянии 1 при все более высоких температурах Т1 Т2, Т3, и т. д., то изотермы реального газа будут все дальше отходить от осей координат p-V и горизонтальный участок на них будет уменьшаться. При некоторой, достаточно высокой, температуре которая называется критической температурой Ткр горизонтальный участок изотермы исчезнет, превратившись в точку К. Состояние изображаемое этой точкой, называется критическим состоянием вещества. В критическом состоянии исчезает различие между жидкостью и паром: жидкость непрерывно переходит в пар, а пар - в жидкость. На рис. штриховой куполообразной кривой ограничена область двухфазного состояния вещества, т. е. когда одновременно существуют и жидкость и ее насыщенный пар. При температуре выше критической никаким сжатием пар нельзя перевести в жидкость, поскольку при критической температуре исчезают силы сцепления между молекулами и вещество остается в газообразном состоянии при любых давлениях и объемах.


