Теплоемкость. Процессы в газах
Первое начало термодинамики – это формулировка закона сохранения энергии с учетом специфической формы энергии – теплоты. Согласно этому закону, количество теплоты, сообщенное макросистеме, идет на приращение ее внутренней энергии и на совершение системой работы против внешних сил.
dU – бесконечно малое приращение функции состояния(полный дифференциал); δQ – бесконечно малое приращение функции, не являющейся термодинамическим потенциалом. Первый постулат несет дополнительные информационные функции, а именно: · не содержит ограничений на преобразование теплоты в работу, в том смысле, что позволяет полностью преобразовать теплоту в работу; · не определяет направление развития процесса, а только согласовывает взаимное изменение величин, если происходит какой-то процесс; · объявляет внутреннюю энергию системы функцией состояния. Это отражено в дифференциальной форме записи уравнения. Количество теплоты, полученное системой в некотором процессе, может быть выражено через ее теплоемкость Сα. Теплоемкость системы – количество тепла, которое нужно сообщить системе, чтобы повысить ее температуру на 1 К. Тогда
 (4) (4)
где α; – параметр, определяющий процесс; υ – количество молей вещества;
Cμ/μ = с – удельная теплоемкость; m –масса тела. Молярные теплоемкости Cp,Cv являются функциями состояния;
Cp- Cv= R – уравнение Майера (справедливо только для идеального газа).
|


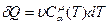
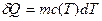
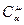 – молярная теплоемкость;
– молярная теплоемкость;


