Над идеальным раствором
С поверхности жидкого или твердого тела при любой температуре происходит испарение частиц (молекул). С другой стороны, происходит и обратный процесс захвата поверхностью частиц из газопаровой фазы (адсорбция). Между этими процессами устанавливается динамическое равновесие и давление паров над жидкостью или твердым телом при фиксированной температуре является вполне определенной величиной. Пар, находящийся в равновесии с жидкостью (твердым телом) называется насыщенным. Общее давление паров над раствором (как твердым, так и жидким) складывается из давления паров всех компонентов, испаряющихся с поверхности (парциальных давлений). Эта закономерность известна как закон Дальтона Р=ΣР1, (1) где Р1 – парциальные давления паров всех компонентов раствора. Для идеального раствора парциальное давление каждого компонента пропорционально его мольной доле в растворе (N1)
Р1=Р0·N1, (2) где P0 – общее давление насыщенных паров над раствором. Для бинарного идеального раствора (раствора, состоящего из двух компонентов)
Р1=Р0·N1, Р2=Р0·N2, (3) Эта зависимость известна как одна из формулировок закона Рауля. Графически этот закон можно представить в виде, приведенном на рис. 1.
Рис. 1. Зависимость давления насыщенных паров над раствором от его состава
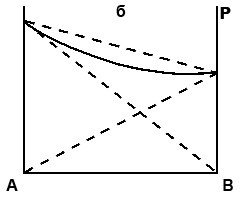
Точка P Отклонения от закона Рауля проявляются в искажении прямых на рис. 1. Эти отклонения могут быть положительными (выпуклые кривые) или отрицательными (вогнутые кривые на рис.2). Для неидельных растворов уравнение (3) применимо только в случае, если концентрация растворенного вещества в растворе очень мала. Отклонения от идеальности вызываются химическими и физическими эффектами, сопровождающими образование реального раствора (ассоциация, диссоциация, сольватация и др.). По отклонению свойств раствора от идеальности судят об интенсивности взаимодействия между частицами растворителя и растворенного вещества в растворе. Положительные отклонения от закона Рауля объясняются тем, что сила взаимодействия между частицами растворенного вещества и растворителя (А - В) по сравнению с силами взаимодействия между частицами одного и того же вещества (А - А или В - В). В этом случае связывание компонентов в растворе уменьшается, а летучесть - возрастает. Образование такого раствора обычно сопровождается увеличением объема и выделением тепла (пример – растворы этилового спирта и диэтилового эфира).
Рис. 2. Отклонения зависимости давления насыщающих паров для бинарных растворов от закона Рауля: а – положительное отклонение, б – отрицательное отклонение.
Для растворов с отрицательным отклонением от закона Рауля характерно уменьшение давления паров над раствором по сравнению с идеальными растворами. Эти отклонения связаны с более сильным взаимодействием между частицами компонентов раствора по сравнению с чистыми компонентами. Отрицательные отклонения наблюдаются для растворов, склонных к образованию ассоциатов, сольватов и т.п. (например – водные растворы кислот, солей и оснований). Образование таких растворов сопровождается обычно уменьшением объема и выделением тепла. Парообразование с поверхности такого раствора затруднено, что и вызывает отрицательные отклонения. Если растворенное вещество нелетучее или малолетучее, то при относительно невысоких концентрациях в растворе можно пренебречь давлением его паров над раствором. Следовательно,
P0 = P1+P2 = P0·N1, N1+N2=1. (4) То есть давление паров растворителя над раствором всегда ниже, чем над чистым растворителем, так как его доля в растворе всегда меньше единицы. Данная закономерность известна как другая формулировка закона Рауля, согласно которой относительное понижение давления паров растворителя над раствором по сравнению с чистым растворителем (ΔР) равно мольной доле растворенного вещества (N2):
На рис. 3 приведены кривые, иллюстрирующие влияние концентрации растворенного вещества на давление насыщенного пара над поверхностью раствора. Известно, что жидкость закипает при той температуре, когда давление насыщающих паров над ней достигает внешнего (например – атмосферного) давления. Следовательно, чем ниже давление насыщающих паров над раствором, тем при более высокой температуре он будет закипать (дополнительное повышение температуры необходимо для того, чтобы достичь внешнего давления).
Рис. 3. Зависимость температуры кипения и отвердевания растворов от их концентрации
Кривая 0 соответствует зависимости давления насыщающих паров растворителя от температуры для чистого растворителя, а кривые 1 и 2 – для различных растворов. При этом концентрация 2-го раствора (кривая 2) выше концентрации 1-го раствора (кривая 1).
|


 отвечает давлению пара над чистым компонентом А, а точка P
отвечает давлению пара над чистым компонентом А, а точка P  – давлению пара над чистым компонентом В. Верхняя прямая получается путем сложения кривых, определяющих парциальное давление каждого из компонентов.
– давлению пара над чистым компонентом В. Верхняя прямая получается путем сложения кривых, определяющих парциальное давление каждого из компонентов.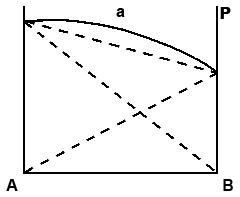
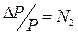 . (5)
. (5)



