Выражение количественного состава растворов
Наряду с температурой и давлением основным параметром состояния раствора является концентрация в нем растворенного вещества. Концентрацией раствора называется содержание растворенного вещества в определенной массе или в определенном объеме раствора или растворителя. Концентрацию раствора можно выражать по-разному. В химической практике наиболее употребительны следующие способы выражения концентраций: а) массовая доля растворенного вещества показывает число граммов (единиц массы) растворенного вещества, содержащееся в 100 г (единиц массы) раствора (ω, %)
ω (%) =
б) мольно-объемная концентрация, или молярность, показывает число молей (количество) растворенного вещества, содержащихся в 1 дм3 раствора (с или М, моль/дм3)
в) эквивалентная концентрация, или нормальность, показывает число эквивалентов растворенного вещества, содержащихся в 1 дм3 раствора (сэ или н, моль/дм3)
г) мольно-массовая концентрация, или моляльность, показывает число молей растворенного вещества, содержащихся в 1000 г растворителя (сm, моль / 1000 г)
д) титром раствора называется число граммов растворенного вещества в 1 см3 раствора (Т, г/см3) T = mр.в./V. Кроме того состав раствора выражается через безразмерные относительные величины -доли. Объемная доля - отношение объема растворенного вещества к объему раствора; массовая доля - отношение массы растворенного вещества к объему раствора; мольная доля отношение количества растворенного вещества (число молей) к суммарному количеству всех компонентов раствора. Наиболее употребительной величиной является мольная доля (N) – отношение количества растворенного вещества (ν1) к суммарному количеству всех компонентов раствора, то есть ν1 + ν2 (где ν2 –количество растворителя) Nр.в. = ν1/(ν1 + ν2) = mр.в./Мр.в./(mр.в./Мр.в + mр-ля./Мр-ля).
|

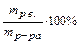

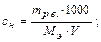
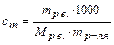 ;
;


