Решение.
Кр = ∆ rG0Т = - RT ln Кр Þ Kp = exp(- ∆G0Т / RT) ∆ rG0298 = 120,15 кДж; ∆ rG01000 = -3,16 кДж Кр 298= exp(-120.103/8,31.298)= ехр(-48,5) =8×10-22; Kp 1000 =exp(+3160/8,31.1000)= ехр(0,38) = 1, 46. Кс = ∆ν = 2-1=1 · При 298 К - Кр ® 0 Þ в равновесной смеси практически отсутствуют продукты и смещение Þв сторону исходных веществ. · При 1000 К - Кр > 1 Þ в равновесной смеси начинают преобладать продукты, их выход растет с увеличением Т. Т.К. с увеличением температуры Кр увеличивается Þ ∆ rH0 > 0 ▼ Задача. Для реакции: А(г) = 2В(г) (Р,Т – const) Кр = 0,02 при 400 К и Кр =4,00 при 600 К. Определить ∆ rH 0298, ∆ rS0298 и Кр при 800 К. Решение. Пренебрегаем зависимостью ∆ rH 0 и ∆ rS 0 от температуры Составим систему из двух уравнений с двумя неизвестными (T 1=400 K, T 2=600 K):
∆ rG0Т 2= ∆ rH0298 – T 2∆ rS0298 = - RT 2ln Кр 2
x – 600 y = -8,31.600 ln4 х = ∆ rH 0298 = 52833(Дж) = 52,833 кДж; y = ∆ rS 0298 = 99,575 Дж/К. ln ▼ Задача. Определите Т, при которой в реакции СаСО3(к) = СаО(к) + СО2(г) р СО2,равн = 104 Па. Решение. Кр = р СО2, Кр = 104/105=0,1. Пренебрегаем зависимостью ∆ rH 0 и ∆ rS 0 от Т: ∆ rG0Т = ∆ rH0298 – T ∆ rS0298 = - RT ln Кр ∆ rH 0298=∆ fH0298, СаО+∆ fH0298, СО2-∆ fH0298, СаСО3=178,1 кДж;
∆ rS 0298 = S 0298,CаО+ S 0298,СО2 - S 0298,СаСО3 = 160,5 Дж/К 178,1.103 – Т .160,5= -8,31 Т ln0,1 Þ Т = 991К ▼ Задача. Определить равновесный состав системы С(к) + СО2(г) = 2СО(г) Т= 1000 К Р общ = 2атм n исх CO2 = 5 моль
|

 ; Кс =
; Кс = 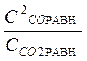
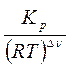 =
=  = 0,018
= 0,018 ∆ rG0Т 1= ∆ rH0298 – T 1∆ rS0298 = - RT 1ln Кр 1
∆ rG0Т 1= ∆ rH0298 – T 1∆ rS0298 = - RT 1ln Кр 1  x – 400 y = -8,31.400 ln2.10-2
x – 400 y = -8,31.400 ln2.10-2  = ln
= ln 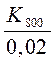 =
=  (
(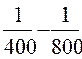 )= 7,95; К 800 = 56,55
)= 7,95; К 800 = 56,55


