Тепловой эффект реакции зависит от температуры
Þ указывают температуру Dr Н т или Dr Н от, например Dr Н 298 или Dr Н о298
Dr Н т (1) = Dr Н т (2) + Dr Н т(3)
Например: СН4 + 2О2 = СО2 + 2Н2О (г), Dr Н °298 = – 802,34 кДж Эту же реакцию можно провести через 2 стадии: 1. СН4 + 3/2О2 = СО + 2Н2О (г) Dr Н °1 = – 519,33 кДж, 2. СО + 1/2О2 = СО2, Dr Н °2 = – 283,01 кДж, Dr Н ° = Dr Н °1 + Dr Н °2 = (– 519,33) + (– 283,01) = = – 802,34 кДж
D fН простых веществ, устойчивых при 298 К и давлении 101 кПа принимают равной 0 (О2-газ, Br2-жидкость, Р-белый, Snбелое, Sромб.) Если вещества в стандартном состоянии - D fНo 298 – стандартная энтальпия образования вещества (табличные данные)
H2(г)+2O2(г)+S(к)=H2SO4(ж); Dr Н °298 = Δ fН 0298 (H2SO4) = -811,3 кДж/моль
½H2(г) + ½N2(г) + 1½O2(г) = 1HNO3(ж) + Δ fН 0298 ( HNO3 ) Dr Н °298 = Δ fН 0298 ( HNO3 ) = - 174,3 кДж/моль
Δ сгН 0298 – тепловой эффект сгорания 1 моль вещества в кислороде до высших оксидов, устойчивых в стандартном состоянии.
Следствие из закона Гесса:
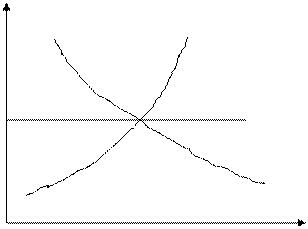
Зависимость Δ rН 0 от температуры - уравнение Кирхгофа: Т 1. ∆ rH0T = ∆ rH 0298 + ∫ ∆ rС0pdT (р = const) 298 ∆ rСp о = Δ a + Δ bT +Δ c ′ T -2+Δ cT 2 - изменение стандартной теплоемкости системы в ходе реакции в изобарном процессе. а, b, c, c ′ - коэффициенты уравнения температурной зависимости теплоемкости (табулированы). Влияние температуры на ΔrН:
∆ rСp <0 ∆ rСp >0
∆ rСp =0
Т
2. Если пренебречь зависимостью Ср от Т (Ср =соnst): ∆ rН 0 Т = ∆ rН 0298 + ∆ rС 0 р (Т - 298) ∆ rСp о = ∑ν iСрi 0 прод - ∑ν jСрj 0исх веществ изменение стандартной теплоемкости системы в ходе реакции: разность молярных изобарных теплоемкостей всех продуктов реакции и молярных изобарных теплоемкостей исходных веществ 3. Если считать ∆ rС 0 р = 0: ∆ rH0T = ∆ rH 0298
Задача Рассчитать ∆ rH 0298 и ∆ rH 01000 реакции С(к) + СО2(г) = 2СО(г), считая постоянными теплоемкости реагентов в данном температурном интервале.
|






 ∆ rН
∆ rН


