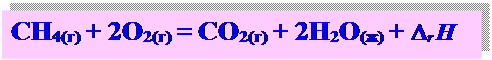Первое начало термодинамики. переход системы из состояния I в состояние II:
переход системы из состояния I в состояние II:
- cистема I производит работу (или над нею совершается работа) – W; - принимает участие в теплообмене с окружающей средой (выделяет или поглощает теплоту) - Q. По закону сохранения энергии: Q = DU + W, (1) Q – количество сообщенной системе теплоты; D U = U2 – U1 – приращение внутренней энергии; W – суммарная работа, совершенная системой.
U - функция состояния системы Q – не функция состояния системы Пусть - только рDV- работа, совершаемая системой против сил внешнего давления (работа расширения) Для бесконечно малых элементарных процессов уравнение принимает вид: d Q = dU + рdV (2)
а) изохорный процесс – V = const, тогда dV = 0 и работа расширения системы dW = рdV = 0 первый закон термодинамики: d QV = dU и QV = U2 – U1 = DU при данных условиях - QV - функция состояния, т.е. не зависит от пути процесса б) изобарный процесс - р = const Qp = D U + р D V Т.к. D U= U2 – U1, D V = V2 – V1, то Qp = U2 – U1 + рV2- – рV1 = (U2+ рV2) – (U1 + рV1) Qp = H2 – H1 = D H
Энтальпия – функция состояния (теплосодержание, энергосодержание, включая внутреннюю энергию)
Для идеальных газов: p ∆ V = ∆ν RT, ∆ν; – разница между числом молей газообразных продуктов и исходных веществ.
Термохимия - часть термодинамики, изучающая тепловые эффекты химических процессов. Термохимические уравнения - химические уравнения реакций, в которых указаны агрегатные состояния веществ и тепловые эффекты
Тепловой эффект химической реакции – это изменение энергии системы при протекании реакции, при условии, что система не совершает другой работы, кроме работы расширения. ▼ изохорические условия (V = const)- QV = DU ▼ изобарические условия - тепловой эффект равен Qp = H2 – H1 = D r H - энтальпия реакции Если вещества находятся в стандартном состоянии – стандартная энтальпия реакции D r H 0
|




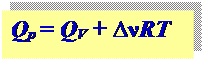 связь между Qp и QV:
связь между Qp и QV: