Тесты для самоконтроля. а) 5 г СаС12 растворено в 95 г Н2О, б) 5 г СаС12 растворено в 100 г Н2О,
ТЕСТ 1 1. Выражение ω (СаС12)= 5% означает: а) 5 г СаС12 растворено в 95 г Н2О, б) 5 г СаС12 растворено в 100 г Н2О, в) 5 г СаС12 растворено в 1000 г Н2О. 2. Эквивалентная масса меди в соединении СuSO4 равна: а) 80,0 г/моль, б) 31,75 г/моль, в) 79,5 г/моль, г) 16 г/моль. 3. Укажите истинный раствор: а) мел + вода, б) вода + поваренная соль, в) вода + глина, г) вода + масло. 4. Молярная концентрация показывает: а) сколько г растворенного вещества содержится в 100 г воды; б) сколько молей растворенного вещества содержится в 1 л раствора; в) сколько моль-экв растворенного вещества содержится в 100 мл раствора; г) сколько мл растворенного вещества содержится в 1000 мл раствора. 5. Эквивалентую массу щавелевой кислоты, вступающей в реакцию c гидроксидом натрия, рассчитывают по следующей формуле: а) МЭкв=2М, б) МЭкв=М/2, в) МЭкв=М/4, г) МЭкв=М/n.
ТЕСТ 2 1. Нормальная концентрация – это количество моль вещества, растворенного в: а) 1 л раствора, б) 1 л растворителя, в) 100 г растворителя, г) 100 г раствора. 2. Титр показывает сколько: а) г вещества содержится в 1000 мл раствора, б) г вещества содержится в 1 мл раствора, в) г вещества содержится в 100 г раствора. 3. Приведите основную формулу для определения концентраций в объемном анализе. а) С1V2= С2 V1, б) С1V1= С2 V2, в) 4. Масса хлорида натрия количеством вещества 0,8 моль равна: а) 58,5 г, б) 46,8 г, в) 29,25 г. г) 56,25г. 5. Массовая доля показывает количество: а) моль-экв/л; б) г растворенного вещества на 100 г воды; в) 1 моль вещества в 1 л раствора; г) г растворенного вещества в 100 г раствора.
ТЕСТ 3 1. Титр показывает сколько: а) г вещества содержится в 1000 мл раствора, б) г вещества содержится в 1 мл раствора, в) г вещества содержится в 100 г раствора. 2. Эквивалентная масса меди в соединении СuSO4 равна: а) 80,0 г/моль, б) 31,75 г/моль, в) 79,5 г/моль, г) 16 г/моль. 3. Молярная концентрация показывает: а) сколько г растворенного вещества содержится в 100 г воды; б) сколько молей растворенного вещества содержится в 1 л раствора; в) сколько моль-экв растворенного вещества содержится в 100 мл раствора; г) сколько мл растворенного вещества содержится в 1000 мл раствора. 4. Приведите основную формулу для определения концентраций в объемном анализе. а) С1V2= С2 V1, б) С1V1= С2 V2, в) 5. Укажите истинный раствор: а) мел + вода, б) вода + поваренная соль, в) вода + глина, г) вода + масло.
ТЕСТ 4 1. Массовая доля показывает количество: а) моль-экв/л; б) г растворенного вещества на 100 г воды; в) 1 моль вещества в 1 л раствора; г) г растворенного вещества в 100 г раствора. 2. Масса хлорида натрия количеством вещества 0,8 моль равна: а) 58,5 г, б) 46,8 г, в) 29,25 г. г) 56,25г. 3. Эквивалентую массу щавелевой кислоты, вступающей в реакцию c гидроксидом натрия, рассчитывают по следующей формуле: а) МЭкв=2М, б) МЭкв=М/2, в) МЭкв=М/4, г) МЭкв=М/n. 4. Молярная концентрация показывает: а) сколько г растворенного вещества содержится в 100 г воды; б) сколько молей растворенного вещества содержится в 1 л раствора; в) сколько моль-экв растворенного вещества содержится в 100 мл раствора; г) сколько мл растворенного вещества содержится в 1000 мл раствора. 5. Эквивалент Cu(NO3)2 равен: а) 188 г/моль; б) 171 г/моль; в) 94 г/моль; г) 114 г/моль.
ТЕСТ 5 1. Приведите основную формулу для определения концентраций в объемном анализе. а) С1V2= С2 V1, б) С1V1= С2 V2, в) 2. Выражение ω (СаС12)= 5% означает: а) 5 г СаС12 растворено в 95 г Н2О, б) 5 г СаС12 растворено в 100 г Н2О, в) 5 г СаС12 растворено в 1000 г Н2О. 3. Массовая доля метилового спирта в растворе, содержащем 60 г спирта и 40 г воды равна: а) 2, б) 0,6, в) 1,5, г) 0,5. 4. При полной нейтрализации Н3РО4 её эквивалент равен: а) 49 г/моль, б) 98 г/моль, в) 32,6 г/моль, г) 196 г/моль. 5.Методом точной навески можно приготовить раствор: а) Na2CO3, б) HCl, в) H2SO4, г) KOH.
Ответы к тестам ТЕСТ 1
ТЕСТ 2
ТЕСТ 3
ТЕСТ 4
ТЕСТ 5
Литература ЛИТЕРАТУРА ОСНОВНАЯ 1. Общая химия. Биофизическая химия. Химия биогенных элементов: Учебник для медицинских вузов. /Ю.А. Ершов, В.А. Попков, А.С. Берлянд и другие. Под ред. Ю.А. Ершова, 8 изд.,560 с. – М.: Высш. Шк., 2010. 2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учебное пособие для студентов медицинских вузов.(Ред. В.А. Попков).- М., Высшая школа, 4 изд., 239 с., 2008 г. 3. Сборник задач и упражнений по общей химии. Учебное пособие. (С.А.Пузаков, В.А. Попков, А.А. Филиппова). М: Высшая школа, 4 изд., 255с., 2010г.
ЛИТЕРАТУРА ДОПОЛНИТЕЛЬНАЯ 1. Общая химия. Учебник для медицинских вузов. (В.А. Попков, С.А. Пузаков), 976с.- ГЭОТАР Медиа, 2007г.
|

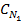 V2=
V2= 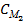 V1
V1


