Методики
Определение взвешенных частиц и запыленности Этот показатель качества талой воды определяют путем фильтрования определенного объема талой воды через бумажный фильтр и последующего высушивания осадка на фильтре в сушильном шкафу до постоянной массы. Для анализа берут 500-1000 мл талой воды. Фильтр перед работой взвешивают на аналитических весах и высушивают в сушильном шкафу до постоянной массы. После фильтрования осадок с фильтром также высушивают до постоянной массы при температуре 100-105˚С, охлаждают и взвешивают. Содержание взвешенных веществ в г/л в испытуемой пробе определяют по формуле: С = (m2-m1)*1000/V где m2 – масса бумажного фильтра с осадком взвешенных частиц, г; m1 – масса бумажного фильтра до опыта, г; V – объем пробы, мл.
Подбор оборудования: фильтр «синяя лента», пластмассовая воронка, банка трехлитровая, мерные стаканы на 500 и 1000 мл, пластмассовая бутыль на 500 мл, пинцет, технические и аналитические весы, сушильный шкаф. Порядок выполнения работы: 1. чистый фильтр занумеровала и вложила в бюкс; 2. бюкс с вложенным фильтром поместила в сушильный шкаф; 3. высушила фильтр в сушильном шкафу при температуре 105˚С в течение одного часа; 4. охладила бюкс с вложенным фильтром на воздухе; 5. взвесила бюкс с фильтром на аналитических весах; 6. довела до постоянной массы бюкс с фильтром (m1); 7. в журнале записала массу m1; 8. вложила фильтр в пластмассовую воронку; 9. воронку с фильтром вставила в пластмассовую бутыль (V = 500 мл); 10. порциями сливала талую воду на фильтр; 11. по мере накопления фильтрата в пластмассовой бутыли, сливала его в мерный стакан на 1000 мл, тем самым измеряя объем фильтрата, а затем в трехлитровую банку; 12. переместив количественно взвешенные частицы анализируемой пробы на фильтр, подсушила его на воздухе; 13. поместила подсушенный фильтр в тот же самый бюкс и сушила при 105˚С в течение одного часа; 14. охладила бюкс с вложенным фильтром на воздухе; 15. взвесила бюкс с фильтром на аналитических весах; 16. довела до постоянной массы бюкс с фильтром (m2); 17. записала массу m2; 18. содержание взвешенных частиц (г/л) рассчитала по формуле.
Содержание взвешенных частиц в снежном покрове является важным показателем загрязненности атмосферного воздуха, определяющая его запыленность. Пылевая нагрузка – это количество твердых выпадений за единицу времени на единицу площади и рассчитывается по формуле: Рn=P/(S·t) где Р – масса пыли в пробе (мг; кг); S – площадь шурфа (м2; км2); t – время от начала снегостава (количество дней).
Определение удельной электропроводности и минерализации
Удельная электропроводность – это электрическая проводимость слоя электролита, находящегося между сторонами куба с длиной сторон 1см, численно равная току, проходящему через слой раствора электролита с площадью поперечного сечения 1 см2 при градиенте приложенного электрического потенциала 1 В/см. Удельная электропроводность зависит от природы электролита и растворителя, от концентрации раствора и от температуры. Удельная электрическая проводимость и минерализация проб определяется на кондуктометре «Анион-7020». Порядок выполнения измерений 1. Перед работой промыть кондуктометрическую ячейку (ДКВ-1) дистиллированной водой и просушить фильтровальной бумагой. 2. Подключить ячейку к измерительному устройству. 3. Погрузить ячейку в дистиллированную воду и включить установку (включить «СЕТЬ» и нажать «ПУСК»). 4. Датчик погрузить в раствор так, чтобы полностью закрыть кондуктометрическую ячейку раствором (водой). Расстояние между корпусом датчика и стенками сосуда не менее 1 см. 5. Прогреть прибор не менее 5 минут при периодическом перемешивании раствора. Для перемешивания можно использовать датчик ДКВ-1. 6. Снять показания удельной электропроводности и минерализации. 7. После окончания работы датчик промыть дистиллированной водой и высушить фильтровальной бумагой. Хранить в сухом состоянии. Примечание: Относительная погрешность при измерении УЭП: - в диапазоне до 20 мкСм/см ± 2,5%; - в диапазоне свыше 20 мкСм/см ± 4,0%. Относительная погрешность при измерении с NaCl ± 5,0%.
Определение содержания сульфатов
Турбидиметрический метод основан на использовании зависимости между ослаблением интенсивности светового потока, проходящего через светорассеивающую среду, за счет рассеивания света частицами этой среды, и их концентрацией. При турбидиметрических измерениях через светорассеивающую среду пропускают световой поток с интенсивностью I0, измеряют его интенсивность I после прохождения им светорассеивающей среды. При наличии частиц, рассеивающих свет (рэлеевское рассеяние), очевидно, что I < I0. В таком случае справедливо соотношение S = lg I0 / I = kcl = τl, аналогичное соотношению для основного закона светопоглощения. В выражении величину S, играющую роль оптической плотности, иногда называют мутностью; k – коэффициент пропорциональности, зависящий от размера рассеивающих частиц, длины волны падающего (рассеиваемого) света, коэффициентов светопреломления частиц и среды; с – концентрация светорассеивающих частиц; l – толщина рассеивающего слоя; τ = kc – коэффициент мутности, иногда называемый также мутностью. Для измерения мутности S используют обычные фотоэлектроколориметры, а также специальные приборы – турбидиметры. Турбидиметрический метод основан на измерении интенсивности помутнения пробы талой воды, содержащей сульфат-ионы, при взаимодействии с хлоридом бария. Для стабилизации образующейся суспензии в смесь вводят гликолевый или желатиновый реагенты. Чувствительность метода 2 мг/л.
Приготовление основного стандартного раствора сульфата калия. 0,9071 г K2SO4 растворяют в мерной колбе вместимостью 1 л в дистиллированной воде и доводят объем раствора дистиллированной водой до метки. 1мл раствора содержит 0,5 мг сульфат-иона SO42-. Приготовление 5%-ого раствора хлорида бария. 5 г BaCl2∙2H2O растворяют в дистиллированной воде и доводят объем до 100 мл. Приготовление 1%-ого раствора желатина. 1 г желатина растворяют в 100 мл дистиллированной воды. Приготовления раствора соляной кислоты (1:1). В стакан вместимостью 200 мл вносят 50 мл дистиллированной воды и добавляют при перемешивании 50 мл концентрированной соляной кислоты. Для построения калибровочного графика в ряд мерных колб вместимостью 50 мл вносят 0,0 (нулевой раствор); 0,2; 0,5; 0,8; 1,0; 1,5; 2,0; 2,5; 3,0; 4,0 мл основного стандартного раствора сульфата калия (0,5 мг SO42- в 1 мл) и доводят объем до метки дистиллированной водой. Приготовленные растворы содержат 0,0; 2,0; 5,0; 8,0; 10,0; 15,0; 20,0; 25,0; 30,0; 40,0 мг/л SO42-. Отмеривают по 5 мл из каждого раствора в мерные пробирки на 15 мл. В каждую пробирку с образцовым раствором прибавляют по 2 мл раствора соляной кислоты (1:1) и 5%-ого раствора хлорида бария, 3мл 1%-ого раствора желатина, тщательно перемешивают и выдерживают в течение 10 – 15 минут. Выбор оптимального светофильтра и рабочей кюветы. Для этого на ФЭК марки КФК-2 измеряют интенсивность выходящего светового потока (мутность) S на различных длинах волн относительно нулевого раствора в стандартных кюветах. Строят кривую S = f (λ;, нм) и подбирают оптимальный светофильтр. Затем подбирают размер рабочей кюветы. Анализ пробы. К 5 мл талой воды добавляют по 2 мл раствора соляной кислоты (1:1) и 5%-ого раствора хлорида бария, 3мл 1%-ого раствора желатина, тщательно перемешивают и выдерживают в течение 10 – 15 минут. Затем измеряют мутность S. Анализ холостой пробы. К 5 мл талой воды добавляют 2 мл раствора соляной кислоты (1:1) и 3мл 1%-ого раствора желатина, тщательно перемешивают и выдерживают в течение 10 – 15 минут. Затем измеряют мутность S’. Массовую концентрацию сульфатов в пробе С, мг/л, в пробе талой воды определяют по формуле: С = S - S’/b (13), где S – оптическая плотность пробы талой воды; S’ – оптическая плотность холостой пробы; b – угловой коэффициент (наклон) градуировочной характеристики. Порядок выполнения измерений на «КФК-2МП»: 1. открыть крышку кюветного отделения (рукоятка кюветодержателя при этом должна быть в положении 1 «влево до упора»); 2. включить прибор в сеть и включить тумблер «СЕТЬ»; 3. нажать клавишу «ПУСК», загорится светодиод «Р»; 4. при использовании циклического режима нажать клавишу «Ц/Р», загорится светодиод «Ц»; 5. нажать клавишу «Ш(0)», загорится символ «0»; 6. установить ручками нужный светофильтр и фотоприемник; 7. вставить кюветы (контроль – в дальнее гнездо, анализируемый раствор – в ближнее); 8. закрыть крышку кюветного отделения; 9. нажать клавишу «К1» (соблюдать паузы в 3-5 секунд), загорится символ «1»; 10. рукоятку кюветного отделения повернуть в положение 2 «вправо до упора»; 11. нажать клавишу «Т2» или»Д5» (соблюдать паузы в 3-5 секунд), загорится символ «2» или «5», соответственно; 12. снять показания прибора; 13. рукоятку кюветного отделения повернуть в положение 1 «влево до упора»; 14. открыть крышку кюветного отделения; 15. повторить операции 5, 8-14 три раза и найти среднее арифметическое измеряемого параметра; 16. сменить кювету и повторить операции 4-15; 17. по окончании работы выключить прибор из сети и закрыть его чехлом.
Выбор рабочей кюветы
Построение калибровочного графика
Подбор реактивов и оборудования:K2SO4 (крист.), BaCl2∙2H2O (крист.), желатин, HCl (конц.), дистиллированная вода, мерные колбы с пробками на 50 мл (10 штук) 100 мл и 250 мл, стакан на 200 мл, набор мерных пипеток (2, 5 и 10 мл), набор мерных пробирок на 15 мл (10 штук), чистые склянки с пробками для хранения растворов, водяная баня, технические и аналитические весы, набор кювет, КФК-2МП. Приготовление основного стандартного раствора сульфата калия (С SO42- –0,5 мг/мл). Для приготовления раствора необходимо растворить 0,9071 г K2SO4 в 1 л дистиллированной воды. Приготовила 0,25 л раствора. 0,9071 г K2SO4 – 1,00 л Х г K2SO4 – 0,25 л Х = 0,9071 г ∙0,25 л/1,00 л = 0,2267 г g (теор.) = 0,2267 г Взятие навески: m (пустой капсулы) = 0,7761 г g (теор.) + m (пустой капсулы) = 0,7761 г + 0,2267 г = 1,0028 г m (капсулы + навеска) = 1, 0038 г m (капсулы с остатками) = 0,7767 г g (практич.) = m (капсулы + навеска) - (капсулы с остатками) = 1,0038 г – 0,7767 г = 0,2271 г Растворение навески – см. стр. Раствор перелила в чистую посуду. Приготовление 5%-ого раствора хлорида бария. Взвесила 5,00 г BaCl2∙2H2O(крист.) на технических весах, растворила навеску в 100 мл дистиллированной воды в колбе на 100 мл. Раствор перелила в чистую посуду. Растворение навески – см.стр. Приготовление 1%-ого раствора желатина. Мерную колбу (V = 100 мл) заполнила на 1/2 дистиллированной водой и всыпала 1 г желатина и перемешала. После набухания желатина колбу поставила на водяную баню для гомогенизации раствора. Далее довела объем до метки дистиллированной водой. Колбу закрыла пробкой и перемешала. Раствор перелила в чистую посуду. Приготовления раствора соляной кислоты (1:1). В стакан на 200 мл налила 50 мл дистиллированной воды и аккуратно при перемешивании добавила 50 мл концентрированной соляной кислоты. Раствор перелила в чистую посуду.
Приготовила нулевой и стандартный (C (SO42-) = 40,0 мг/л) растворы. Отмерила по 5 мл каждого из них в мерные пробирки на 15 мл и добавила необходимые реагенты.
Выбор длины волны. Поместила в кюветное отделение стандартный и нулевой растворы в кюветах на 1,0 см и измерила оптическую плотность на всех длинах волн. Максимум светопоглощения наблюдается при длине волны равной 400,0 нм. Полученные данные в графической зависимости представлены в таблице Выбор кюветы. Рабочую кювету подбирала, измеряя стандартный раствор (C (SO42-) = 40,0 мг/л) относительно нулевого в различных кюветах при λ = 400,0 нм. Результаты представлены в таблице (приложение). Оптимальная величина А для стандартного раствора с Сmax составляет 0,6-0,8 – этому условию соответствует кювета на 2 см. Анализ проб К 5 мл пробы добавила необходимые реагенты, и измерила оптическую плотность относительно нулевого раствора при λ = 400,0 нм и в кювете на 2 см.
Определение содержания хлоридов
Подготовка к анализу Приготовление растворов сравнения: Калибровочные растворы необходимой концентрации от 10-1 до 10-6 М готовят последовательным разбавлением исходного раствора концентрации 10-1 моль/л. Для его приготовления надо взять 5,8450 г хлорида натрия, растворить в 1 л дистиллированной воды. Подготовка электродов к работе Измерительный электрод подключают к высокоомному входу измерительного прибора, а электрод сравнения – к низкоомноому. Перед началом работы электрод следует промыть дистиллированной водой в течение 10-15 минут с двукратной сменой воды. Электрод сравнения должен быть снабжен солевым мостиком, заполненным 0,1 М раствором нитрата калия. Начать калибровку следует с дистиллированной воды, затем последовательно в калибровочных растворах, начиная с наименьшей концентрации хлорид-ионов. Измерения проводить при постоянном перемешивании раствора. По полученным результатам построить калибровочный график Е=f(lgaCl-). Зависимость логарифма активности хлорид-ионов от концентрации хлорида натрия указана в таблице:
Зависимость логарифма активности хлорид-ионов от концентрации хлорида натрияЗависимость логарифма активности хлорид-ионов от концентрации хлорида натрия
После проведения калибровки необходимо проконтролировать отмывку электрода дистиллированной водой. Считать электрод готовым к работе, если его потенциал в воде отличается от измеренного ранее не более чем на 20-30 мВ. В противном случае отмывку повторить. Измеряют величину потенциала электрода в анализируемом растворе и по калибровочному графику определяют концентрацию хлорид-ионов. Время установления потенциала обычно не превышает 1 мин. Крутизна электродной функции 56±2 мВ. По окончании работы электрод промыть дистиллированной водой и хранить в сухом месте. По результатам определения ЭДС в растворах сравнения на масштабно-координатной бумаге (миллиметровке) строят градуировочный график. По оси абсцисс откладывают значение –рCl растворов сравнения, а по оси ординат – соответствующие им показания прибора. Используя градуировочный график определяют pCl анализируемых растворов. Определение рабочих характеристик электрода проводим по серии стандартных растворов с заданными концентрациями хлорид-ионов в пределах от 1 до 10-7 М. Приготовление серии стандартных растворов Исходный 1М раствор хлорида калия готовим, растворяя навеску 5,850 г KCl в 100 мл дистиллированной воды. Расчет навески: gтеор = С•V•М = 1,0·0,1·58,5 = 5,850 г. gпрак = mкапсулы+соль – mпустой капсулы = 5,9880 – 0,1344 = 5,8536 г. Спрак = gпрак/V·М = 5,854 / 0,1 · 58,5 = 1,001 моль/л Другие стандартные растворы готовим последовательным десятикратным разбавлением исходного раствора. Снимаем показания прибора по каждой концентрации, измерения ведем в трёх повторностях. Результаты представлены в таблице.
Построение градуировочного графика
По полученным данным построили градуировочный график
Рабочие характеристики хлорселективного электрода: 1. Нернстовская область электродной функции лежит в интервале 2. Крутизна электродной функции составляет 56 мВ (теоретическая 3. Время отклика составляет 2±1 мин.
Проведение анализа Измеряем величину потенциала электрода в анализируемом растворе и по калибровочному графику определяем концентрацию хлорид-ионов.
Определение содержания нитратов
1. Приготовление стандартных растворов нитрата калия. Используя исходный раствор 1М KNO3, последовательным разбавлением приготовить растворы с концентрацией KNO3 0,1М; 0,01М; 0,001М; 0,0001М; 0,00001М. 2. Калибровка нитрат-селективного электрода по стандартным растворам. Полученные стандартные растворы налить в чистые стаканчики и, погрузив в раствор нитрат-селективный индикаторный электрод и хлорид-серебряный электрод сравнения, измерить ЭДС ячейки (Е,мВ). Измерения проводить, переходя от раствора с меньшей концентрацией к раствору с более высокой концентрацией (в этом случае электрод можно не мыть, а лишь вытирать фильтровальной бумагой). Полученные данные обработать методом наименьших квадратов. Построить калибровочный график Е = f (pNO3ˉ) 3. Измерить ЭДС анализируемого раствора. Используя калибровочный график, определить pNO3ˉ и концентрацию нитрат-ионов в пробе.
Назначение электрода 1. Электрод является преобразовательным элементом, предназначенным для потенциометрического измерения концентрации нитрат-ионов NO3¯ в водных растворах. 2. Электрод может быть использован для работы в лабораторных условиях в составе аналитических средств измерения в паре с электродом сравнения и рН-метром или иономером. Технические характеристики 1. Диапазон рабочих температур анализируемой среды: от 5 до 500С. 2. Диапазон измеряемых концентраций нитратов: 2*10-1 до 2*10-5 моль/л. 3. Оптимальное значение рН анализируемой среды: от 1 до 10. 4. Электрическое сопротивление электрода при температуре 250С: не более 50 Мом. 5. Крутизна электродной характеристики при температуре 250С, 54 ± 3 мВ/рNO3. 6. Электрод допускает избыточное присутствие ионов (при концентрации основного иона 0,1 М); NO2¯ – в 10 раз; Cl¯ – в 50 раз; НРО42-, СН3СОО¯, НСО3¯, СО32- - в 10 раз; SO4 2-– в 1000 раз. Время отклика, не более 3 мин; электрическое сопротивление электрода <100 МОм; потенциал электрода относительно хлорсеребряного электрода сравнения в растворе 10-2, < NO3¯ при 250 С 110 ± 20 мВ. Принцип работы, подготовка электрода и калибровка 1. Принцип работы электрода основан на селективном обмене между ионами мембраны и нитрат-ионами, содержащимися в растворе, в результате чего возникает скачок потенциала, описываемый уравнением: Е = Е0 – RT/ZF * lnα NO3- где Е – измеренный потенциал электрода, В; Е0 – стандартный потенциал электрода, В; R – газовая постоянная, Дж/моль-1, К-1; Т – абсолютная температура, 0К; F – число Фарадея; Z – заряд нитрат-иона; αNО3– активность ионов NO3¯. Такая зависимость выполняется, как правило на участке концентраций нитратов 10-2 до 10-4 моль/л. При меньших и больших концентрациях наблюдаются отклонения от линейности. Однако для вышеуказанного диапазона определения концентраций 2*10-1 до 2*10-5моль/л. Эти отклонения воспроизводимы и могут быть учтены при измерениях концентраций нитрат-ионов. Для этого либо при калибровке строят зависимость Е от логарифма активности нитратов и используют затем ее при расчетах, либо при наличии микропроцессора в приборе заводят такую зависимость в программу расчетов концентраций нитратов. 2. Для определения концентрации нитрат-ионов в исследуемом растворе измеряют потенциал электрода относительно электрода сравнения. Концентрацию нитрат-ионов определяют по калибровочному графику. 3. Электрод состоит из пластмассового корпуса с ионочувствительной мембраной, приклеенной к нижней части корпуса. Внутри корпуса находится хлорсеребряный полуэлемент, герметично закрытый сверху колпачком. Раствор электролита для внутреннего полуэлемента приготавливается и заливается через заливное отверстие в корпус электрода потребителем. 4. Подготовка электрода к работе: - приготовить раствор следующего состава: 0,01 m KNO3(NaNO3) + 0,01 m KCl (1: 1). - залить через отверстие в верхней части электрода (на 10мм ниже колпачка) этот раствор с помощью шприца. Заливку следует провести так, чтобы внутри не остались воздушные пузырьки, которые могут препятствовать контакту электролита с мембраной. Рекомендуется делать заливку порциями – залить часть электролита и затем сильно встряхнуть электрод (как стряхивают градусник), чтобы электролит сместился вниз к мембране, и так повторять до тех пор, пока не заполнится весь электрод. - после заполнения электролитом можно заклеить заливное отверстие скотчем, и проколоть небольшое отверстие с помощью иголки в том месте, где расположено заливное отверстие (это необходимо, чтобы выровнить давление снаружи и внутри корпуса электрода при изменении температуры). - поместить электрод в раствор 0,01 М KNO3 и вымочить в течение 2-3 суток. 5. Проверка работоспособности и калибровка. Проверку работоспособности электрода лучше проводить, погрузив нитратный и вспомогательный электроды в раствор 0,01 М KNO3. Измерительный прибор перевести в режим измерения «мВ». В случае если показания прибора будут устойчивы и воспроизводимы в интервале 130 ±30 мВ, то электрод пригоден для дальнейших измерений. Если показания неустойчивы, то следует проверить заливку электрода электролитом (возможно, внутри электрода остались воздушные пузырьки). Калибровку электрода следует проводить на основе растворов, близких по составу и ионной силе с исследуемым раствором при температуре, близкой к температуре исследуемого раствора. 6. Определение значения pNO3¯ в анализируемом растворе. Проверка рабочих характеристик первого электрода.
Определение Нернстовской области
Рабочие характеристики нитрат-селективного электрода 1. Нернстовская область электродной функции лежит в интервале концентраций нитрат-ионов от 10-1 до 10-5моль/л 2. Крутизна электродной функции составляет 54,6 мВ (теоретическая крутизна 54±3 мВ). 3. Время отклика составляет 2±1 мин. 4. У раствора с концентрацией 10-2 моль/л Е= 156,4 мВ (теоретически 130±30 мВ).
Построение калибровочного графика
Приготовили раствор с концентрацией KNO3 1 М. q = C*M*V q = 1*101,103*0.05 = 5,0552 г Навеску отвесили на аналитических весах и растворили дистиллированной водой в мерной колбе на 50 мл. Взяли 5 мл раствора и налили в мерную колбу на 50 мл, довесли до метки. Аналогично приготовили ещё 4 раствора. Измерили ЭДС.
а = 42,3 в = 54,7 r = 0,999
Определение содержания ионов натрия и калия
Для построения калибровочных графиков используются стандартные растворы хлоридов калия и натрия с концентрацией 10-5 – 1,0 моль/л. Исходный 1 моль/л раствор готовят весовым методом. Остальные растворы готовят последовательным десятикратным разбавлением дистиллированной водой. Для этого берут 2 мерные колбы на 100 мл. В колбу 1 отмеряют из мерной пипетки 10 мл исходного раствора, доводят дистиллированной водой до метки и перемешивают. Полученный стандартный раствор 1 имеет концентрацию (КС1, NaCl) = 1 моль/л. Затем 10 мл раствора 1 переносят пипеткой в колбу 2 и доводят водой до объема 100 мл. Получают стандартный раствор 2 с концентрацией 0,1 моль/л. Таким образом получают стандартные растворы 3, 4 и 5 с концентрациями 10-3 моль/л, 10-4 моль/л и 10-5 моль/л. Калибровка ионоселективного электрода по стандартным растворам Полученные стандартные растворы наливают в чистые стаканчики и, погрузив в раствор ионоселективный индикаторный электрод и хлорсеребряный электрод сравнения, измеряют ЭДС (мВ) ячейки. Измерения проводят переходя от раствора с меньшей концентрацией к раствору с более высокой концентрацией (в этом случае электрод не моют, а лишь вытирают фильтровальной бумагой). Измерения потенциала при калибровке и последующем определении концентрации катионов (натрия и калия) в анализируемом растворе проводят при постоянном перемешивании с фиксированной скоростью и при постоянном времени измерения – 2 мин. По полученным данным строят график: E = f(pX), после предварительной обработки методом наименьших квадратов. Величина b (метод наименьших квадратов) соответствует крутизне электродной функции и далее ее сравнивают с данными паспорта электрода. Анализ пробы Объем талой воды (50 мл) переносят в стакан для измерения. Затем погружают ионоселективный электрод и хлорсеребряный электрод. Перед погружением электрода в исследуемый раствор его следует ополос нуть дистиллированной водой и просушить фильтровальной бумагой. Измеря ют ЭДС (мВ) гальванического элемента, и по калибровочному графику находят значение рМе в исследуемом растворе.
Подбор реактивов и оборудования: дистиллированная вода, КCl (крист.), NaCl (крист.), NH4NO3 (крист.), фильтровальная бумага, калий-селективный электрод, натрий-селективный электрод, хлорсеребряный электрод, электролитический ключ, иономер лабораторный И-160М, мерный цилиндр на 100 мл, стакан химический на 100 мл (7 штук), мерная пипетка на 10 мл, аналитические и технические весы, мерная колба с пробкой на 50 мл (2 штуки).
Порядок выполнения работы: 1. за 30 минут до работы включила прибор в сеть; 2. подключила хлорсеребряный и натрий- (калий)-селективный электроды; 3. рассчитала необходимое количество солей для приготовления 50 мл 1 М растворов: g = Cм∙M∙V где g – навеска вещества, г; Cм – молярная концентрация вещества, моль/л; M – молярная масса вещества, г/моль; V – объем, который раствора этого вещества, л; M (КCl) = 74,555 г/моль; M (NaCl) = 58,443 г/моль; g (КCl) = 1 моль/л∙74,555 г/моль∙0,05 л = 3,7277 г; g (NaCl) = 1 моль/л∙58,444 г/моль∙0,05 л = 2,9222 г; 4. приготовила 1М растворы хлорида натрия хлорида калия:
Взятие навески
Растворение навески: заполнила мерную колбу на 50 мл на 1/3 дистиллированной водой. Высыпала навеску в мерную колбу через сухую воронку. Смыла небольшим объемом воды остатки навески с воронки и горлышка колбы. Растворила соль в налитом объеме воды. Довела объем раствора в колбе дистиллированной водой до метки по нижней границе мениска (последние капли воды добавила глазной пипеткой). Закрыла колбу пробкой и перемешала 15-20 раз. Содержимое колбы вылила в чистую посуду; 5. провела калибровку натрий-селективного электрода: калибровка натрий-селективного электрода проводилась согласно паспорту на электрод ионселективный ЭЛИС-112Na. Техническая характеристика натрий-селективного электрода: диапазон измеряемых концентраций – 10-1 - 10-4 моль/л; крутизна электродной функции (при 20 0С) – 55,0 ± 3мВ/pNa; оптимальный диапазон pH – не менее 6.
Результаты потенциометрического измерения
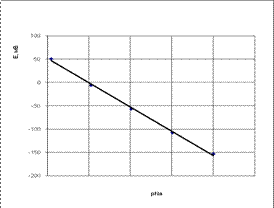
Электрод имеет Нернстовскую электродную функцию в интервале активности, где зависимость потенциала от pNa линейна. Для определения Нернстовской области построили график зависимости Е = f(pNa)) для концентраций больших и меньше на порядок по сравнению с теоретическими, прямой участок на графике будет отвечать Нернстовской области. Y = -52,101х + 51,613 Крутизна электродной функции натрий-селективного электрода составляет 52,1 мВ/pNa (теоретическая крутизна составляет 55,0 ± 3) мВ/pNa. Нернстовская область – 1,05-3,01 pNa. 6. провела калибровку калий-селективного электрода: калибровка калий-селективного электрода проводилась согласно паспорту на электрод ионселективный ХС-К-001 (приложение). Техническая характеристика калий-селективного электрода: диапазон измеряемых концентраций – 1*10-1-5*10-5 моль/л. урутизна электродной функции (при 20 0С) – 55 ± 3 мВ/pК. Оптимальный диапазон pH – 0-8,5.0. В качестве солевого мостика использовался 0,3 молярный раствор NH4NO3 Результаты потенциометрического измерения
Электрод имеет Нернстовскую электродную функцию в интервале активности, где зависимость потенциала от pК линейна. Для определения Нернстовской области построили график зависимости Е = f(pК) для концентраций больших и меньше на порядок по сравнению с теоретическими, прямой участок на графике будет отвечать Нернстовской области. Y = -47,061х + 473,355 Крутизна электродной функции калий-селективного электрода составляет 47,1 мВ/pК (теоретическая крутизна составляет 55 ± 3 мВ/pК). Нернстовская область – 1,11-3,01 рК. . Характеристика электродов
Определение рН
pH анализируемых проб измеряется с помощью карманного рН-метра. Карманные рН-метры типа «CHECKER» предназначены для определения численных показателей степени кислотности или щелочности водной среды и могут использоваться как в лабораторных, так и в полевых условиях. Основные технические данные и характеристики Диапазон измерения: 0,00÷14,00 рН Разрешение: 0,01 рН Точность: ± 0,2 рН Калибровка: по двум точкам с помощью винтов Порядок выполнения измерений 1. Включить прибор с помощью включателя ON/OFF. 2. Снять с электрода защитный колпачок. 3. Погрузить электрод в раствор. Не при каких обстоятельствах не погружать электрод более чем на 5 см. 4. Слегка помешать электродом анализируемый раствор, пока не стабилизируются показания на дисплее. Для получения точных показаний, перед тем как погрузить электрод в новый образец, рекомендуется сполоснуть его исследуемым раствором. 5. После работы электрод необходимо вымыть и хранить в защитном колпачке. Калибровка прибора Одноточечная калибровка: погрузить электрод в буферный раствор с рН, близким к исследуемым растворам и подкрутить с помощью отвертки калибровочный винт «рН 7,0». Двухточечная калибровка: погрузить электрод в буферный раствор с рН = 7,01и подвести показания прибора до 7,01 с помощью калибровочного винта «рН 7,0». Затем, погрузить электрод в буферный раствор с рН = 4,01 или рН = 10,01и подкрутить отверткой винт «рН 4,0», пока индикатор не покажет соответствующее значение рН.
Подбор реактивов и оборудования: дистиллированная вода, насыщенный раствор гидрофталата калия – KC8H5O4 (рН = 4,01), 0,05 М раствор тетрабората натрия – Na2B4O7∙10H2O (рН = 9,18), стакан на 100 мл (2 штуки), фильтровальная бумага, портативный рН-метр. Порядок выполнения работы: 8. включила прибор и сняла защитный колпачок; 9. промыла электрод дистиллированной водой и просушила фильтровальной бумагой; 10. в стакан (V = 100 мл) налила 80 мл дистиллированной воды и погрузила электрод; 11. измерила рН; 12. просушила электрод фильтровальной бумагой; 13. налила во второй стакан 80 мл буферного раствора – насыщенного KC8H5O4 (рН = 4,01); 14. измерила рН; 15. подкрутила отверткой винт «рН 4,0», пока индикатор не стал показывать соответствующее значение рН; 16. промыла стакан и электрод дистиллированной водой, электрод просушила фильтровальной бумагой; 17. налила в стакан 80 мл буферного раствора – 0,05 М Na2B4O7∙10H2O (рН = 9,18); 18. измерила рН; 19. промыла стакан и электрод дистиллированной водой, электрод просушила фильтровальной бумагой; 20. ополоснула стакан обработанной пробой талой воды; 21. налила в стакан 80 мл обработанной пробы талой воды; 22. измерила рН и записала в журнал 23. промыла электрод
|