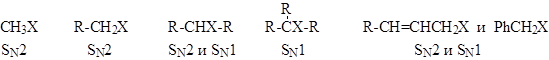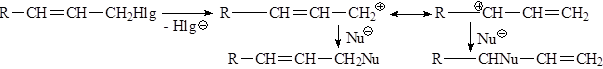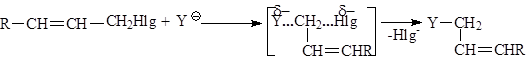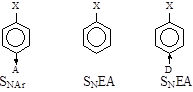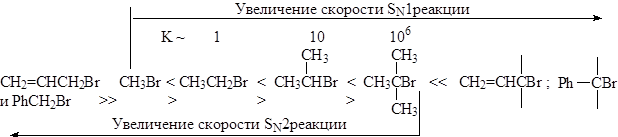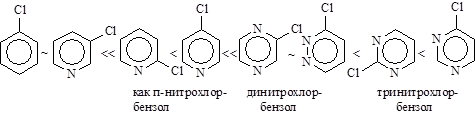Строение субстрата
А. Структура реагирующего соединения определяет механизм замещения галогена (напр., SN1 или SN2; SNAr(AE) или SNAr(EA)). - В алифатических галогенидах:
- Cувеличением разветвленности алифатического радикала в галогенидах создаются стерические препятствия для прямой атаки нуклеофила и увеличивается стабильность промежуточного карбкатиона, поэтому при переходе от первичного алкилгалогенида к третичному, в одних и тех же условиях механизм реакции может измениться от бимолекулярного до мономолекулярного. Этот процесс не является резким и зависит от ряда конкретных условий. Принципиально возможно протекание реакции по двум механизмам одновременно. - Аллил- и бензилгалогениды легко реагируют как по SN1, так и по SN2 механизму. Однако, независимо от разветвленности радикала они образуют очень устойчивые карбокатионы, поэтому преимущественно реализуется SN1-механизм. При этом наблюдается аллильная перегруппировка, так как промежуточный аллилкатион может существовать в двух структурах:
- В ароматических галогенидах наличие электроноакцепторных заместителей в орто -, пара -положениях способствует SNAr замещению, а электронодонорных – механизму SNEA отщепления-присоединения, через дегидробензол.
Б. Структура реагирующего соединения определяет и скорость процессов: 1. Скорости SN1 реакций возрастают от метильного радикала в алкилгалогениде к третичному, аллильному и бензильному, по мере увеличения устойчивости карбкатиона.
Находящиеся в a-положении к реакционному центру предельные, фенильные и винильные радикалы, а также атомы, имеющие неподелённую пару электронов, за счет эффектов индукционного и сопряжения способствуют распределению электронного облака частицы, стабилизируют катион и ускоряют реакцию. 2. Скорости SN2 реакций алкилгалогенидов возрастают в прямо противоположном направлении, наблюдаемому при SN1 замещении, если не учитывать повышенную активность первичных аллил- и бензилгалогенидов. Метильные и первичные галогениды реагируют очень гладко, вторичные – значительно хуже, а третичные часто не реагируют вообще, что объясняется, в основном, пространственными препятствиями для атаки нуклеофила, которые играют в SN2 замещении важную роль. 3. В ароматических галогенидах электроноакцепторные заместители в орто -, пара -положениях существенно облегчают реакцию SNAr замещения, электронодонорные – затрудняют ее. Пространственные факторы при нуклеофильном замещении в ароматическом ряду не являются определяющими, так как атака направлена сбоку к плоскости ароматического ядра.
Так, 2,4,6-тринитрогалогенбензолы реагируют с водой, аммиаком и др. как хлорангидрид кислоты (очень легко!). Динитрогалогенбензолы реагируют с подобными реагентами медленнее. Замена галогена в о - и п -хлорнитробензоле проходит в щелочном растворе при 130-150°С, а хлорбензол гидролизуется до фенола лишь при температуре 350-400°С и давлении выше 30 МПа под действием 5% раствора щелочи и по другому механизму. Активирующее действие групп при одинаковом их размещении относительно галогена изменяется в следующем порядке: N2Å > NO2 ~ NÅ (CH3)3 > CN > SO3H > COOH >> CH2OH Пиридин и хинолин можно рассматривать как аналоги нитробензола. Как и в нитробензоле, большое значение имеет положение галогена в кольце. 3-Галогенпиридины похожи на галогенбензолы, 2-,4-замещенные аналогичны нитрогалогенбензолам, при этом 4-галогенпиридин активнее 2-замещенного.
В диазинах нуклеофильная подвижность атома галогена увеличивается. 2-Хлорпиразин и 3-хлорпиридазин значительно активнее 2-хлорпиридина. Галогенпиримидины еще более активны. 2-Хлорпиримидин реагирует с бутиламином уже при комнатной температуре, а 4-хлорпиримидин трудно выделить в индивидуальном состоянии из-за легкого отщепления хлора. В ряду пятичленных гетероциклов реакции нуклеофильного замещения изучены еще недостаточно.
|