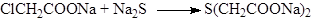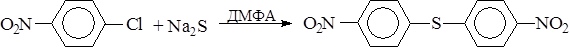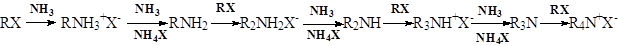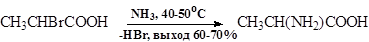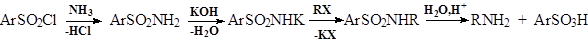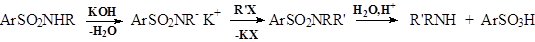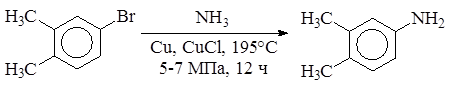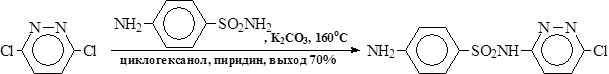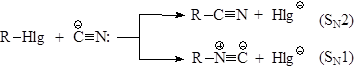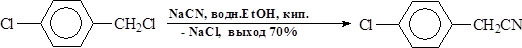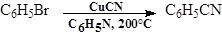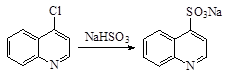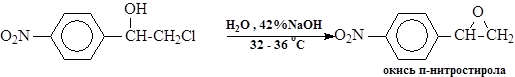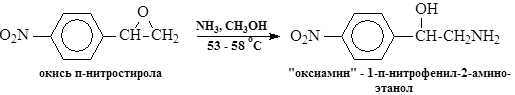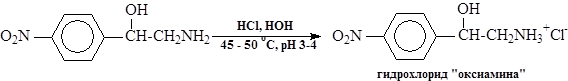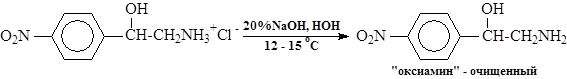Замена атома галогена на меркапто- и алкил(арил)тио- группы
Обычно используются реагенты, содержащие гидросульфид-, сульфид- и алкил(арил)тио-ионы, которые являясь очень сильными нуклеофилами легко взаимодействуют с самыми разными субстратами:
6. Замена атома галогена на аминогруппы –NH2, -NHR, -NR2 А.Замена галогена в алкилгалогенидах на амино группу идет по SN2-механизму. При этом образуется смесь солей:
Лишь a-галогенкарбоновые кислоты при действии большого избытка концентрированного водного раствора аммиака образуют a- аминокислоты.
- Всинтезе БАВприменяют селективные методы получения аминов из галогенидов, например: 1. Синтез первичных и вторичных аминов из амидов сульфокислот:
2. Синтез первичных аминов по Габриэлю из фталимида: и др. Б. Замена галогена на аминогруппу в неактивированных галогенаренах осуществляется при высокой температуре (~ 200оС) и давлении в присутствии катализатора (Cu2O, CuSO4 и т.д.). Используют аммиак или амида натрия в жидком аммиаке.
В. Замена галогена в активированных галогенаренах проходит в условиях, которые зависят от подвижности галогена. Например, реакцию 3,6-дихлорпиридазина с сульфаниламидом (производство сульфопиридазина) ведут при 135-160°С с добавкой значительного количества поташа:
7. Замена атома галогена на CN – группу -относительно простой способ удлинения углеродной цепи. Однако Цианид-ион является амбидентным ионом, поэтому реакция может идти по двум направлениям – с образованием нитрилов и изонитрилов:
Первичные алифатические и бензилгалогениды примесь изонитрилов практически не образуют, выходы нитрилов - хорошие.
В случае ароматическихгалогенидов синтез соответствующих фенилцианидов следует вести при нагревании до 200°С с цианидом меди (I)в пиридине:
8. Замена атома галогена на –SO3Na группу (реакция Штреккера) В качестве реагентов используют сульфиты калия и натрия. Алкил галогениды реагируют по SN2 механизму, активированные арилгалогениды – по SNAr:
Процессы нуклеофильного замещения встречаются и в производстве левомицетина:
Стадия «ДEГИДРОХЛОРИРОВАНИЕ (ЦИКЛИЗАЦИЯ)»
Маслянистый слой нитропродуктов промывают в реакторе водой до остаточной концентрации кислоты не более 1%, охлаждают до 16оС, и при перемешивании к нему приливают 42% раствор NaOH, поддерживая температуру не выше 32-36 оС. Концентрация щелочи в образовавшейся массе I,5—3%. После охлаждения реакционной массы до 20 оС выпавший осадок окиси п-нитростирола центрифугируют и промывают водой. При этом легкоплавкие маслообразные орто- и мета-изомеры отделяются с маточным раствором и передаются на обезвреживание. Выход – 46-47% на ХГС. Примечание. Из маточников можно выделить окись м-нитростирола, которая применяется как ПП в производстве препарата мезатон. Стадия «АМИНИРОВАНИЕ»
Аминирование заключается в нуклеофильном раскрытии эпоксидного кольца раствором аммиака в водном метаноле. Для уменьшения побочных реакций с образованием вторичного и третичного аминов и смол применяют 30-кратный избыток аммиака. В раствор аммиака в водном метанола загружают окись п-нитростирола и смесь выдерживают при 53-58 оС и перемешивании 3—4 часа. Затем метанол с водой и аммиаком отгоняют (при температуре не выше 98оС), остаток растворяют в разбавленной соляной кислоте при рН 3-4 и 45-50 оС и после отстаивания раствор гидрохлорида «оксиамина» с помощью гибкого шланга с фильтром (типа грибок) вакуумом отсасывают из реактора. При этом основная масса смолообразных побочных продуктов остаются в аппарате. Для полного удаления смол раствор гидрохлорида обрабатывают активированным углем. После фильтрации раствора от угля его охлаждают до 12-15 оС и подщелачивают 20%-ным раствором едкого натра. Осадок "оксиамина" отделяют на центрифуге и отмывают водой от щелочи. Выход -57-60% на окись п-нитростирола.
|