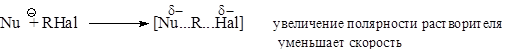Реакционная способность нуклеофила (нуклеофильность)
Чем выше нуклеофильность реагента, тем вероятнее механизм SN2 и быстрее идет процесс, а также возрастает вероятность побочных процессов (например, реакции элиминирования). Однако нуклеофильность - величина переменная, зависящая от различных факторов. Например, в протонных растворителях нуклеофильность анионов Hlg- увеличивается от фторида к иодиду, а в апротонных – наоборот. 4.Влияние растворителя в реакциях нуклеофильного замещения настолько велико, что в ряде случаев определяет механизм реакции. - Полярные протонные растворители (вода, спирты, карбоновые кислоты, аммиак) способствуют протеканию реакций по SN1 механизму, т.к. они: 1) сольватируют и ускоряютдиссоциацию молекулы исходного алкилгалогенида, 2) сольватируют и стабилизируют как катионы, так и анионы, а, следовательно, и увеличиваютскорость процесса в целом. С увеличением полярности и кислотности растворителя тенденция к образованию водородных связей растет, и скорость SN1 – реакции увеличивается. Многие реакции, протекающие в слабо сольватирующих растворителях по бимолекулярному механизму, в среде муравьиной или трифторуксусной кислоты идут по SN1 механизму. - Апротонные нуклеофильные растворители, которые сольватируют главным образом катион (ацетон, ацетонитрил, нитрометан, диметилформамид, диметилсульфоксид, диглим и др.) способствуют протеканию реакций по SN2 механизму. Они не сольватируют уходящих галогенид-ионов, а потому не способствуют их отщеплению. Напротив, отсутствие сольватации нуклеофила увеличивает его активность и способствует прямой нуклеофильной атаке. При выборе растворителя для SN2 реакции необходимо учитывать: - полярность растворителя. Если переходное состояние полярнее, чем исходные реагенты, повышение полярности растворителя увеличивает скорость реакции, и наоборот (теория Хьюза и Ингольда):
- специфическую сольватацию нуклеофила, которая уменьшает активность атакующей частицы. - растворяющую способность растворителя по отношению к реагенту и субстрату. Во многих реакциях в качестве реагентов используются неорганические и органические соли, хорошо растворимые в воде и плохо растворимые в органических растворителях. Для проведения таких реакций в гомогенных условиях применяют растворители, которые проявляют одновременно липофильные и гидрофильные свойства, например, метанол, этанол, ацетон, диоксан. Однако, соли менее растворимы в этих растворителях, чем в воде, а органические субстраты обычно менее растворимы в них, чем в углеводородах. Указанную проблему можно частично решить, используя смеси упомянутых выше растворителей с водой. Более эффективным оказывается применение таких диполярных, апротонных, катионсольватирующих растворителей как диметилсульфоксид, диметилформамид, ацетонитрил, которые хорошо растворяют как соли, так и органические субстраты.
|