Рассмотрим процесс фазового перехода «[U12] жидкость–[U13] пар». Пусть в цилиндре под поршнем находится 1 кг химически чистой, т.е. без примесей и растворенных в ней газов, жидкости, например воды (рис.6.1). Если пренебречь изменением гидростатического давления в жидкости, вызванного действием силы тяжести, то давление в жидкости будет постоянным по высоте и [U14], равным внешнему давлению p. Изобразим состояние жидкости в диаграммах
Рассмотрим процесс фазового перехода «[U12] жидкость–[U13] пар». Пусть в цилиндре под поршнем находится 1 кг химически чистой, т.е. без примесей и растворенных в ней газов, жидкости, например воды (рис.6.1). Если пренебречь изменением гидростатического давления в жидкости, вызванного действием силы тяжести, то давление в жидкости будет постоянным по высоте и [U14], равным внешнему давлению p. Изобразим состояние жидкости в диаграммах  точкой а (рис.6.2). Будем медленно (обратимо) подводить к жидкости теплоту через стенки цилиндра. Температура жидкости будет медленно возрастать, объем ее также будет увеличиваться, но чрезвычайно мало ввиду малости коэффициента
точкой а (рис.6.2). Будем медленно (обратимо) подводить к жидкости теплоту через стенки цилиндра. Температура жидкости будет медленно возрастать, объем ее также будет увеличиваться, но чрезвычайно мало ввиду малости коэффициента
| |
| |  |
объемного расширения жидкостей  . Энтропия жидкости также будет возрастать. Давление жидкости, очевидно, останется постоянным ввиду подвижности поршня и постоянства внешней нагрузки. Процесс нагрева будет продолжаться до некоторого состояния, обозначенного на диаграммах одним штрихом ('). Начиная с этого момента, дальнейший подвод теплоты не приводит больше к изменению температуры в цилиндре. Начинается фазовый переход – превращение жидкости в пар. Но не вся жидкость мгновенно переходит в пар, количество жидкости, превратившейся в пар, оказывается пропорциональным подведенному с начала кипения количеству теплоты. Поршень теперь заметно поднимается вверх, так как удельный объем пара значительно выше удельного объема жидкости. Физически постоянство температуры во время фазового перехода при постоянном давлении объясняется тем, что в этом случае энергия, подведенная к жидкости извне в форме теплоты, тратится не на увеличение кинетической энергии молекул жидкости (пропорциональной температуре), а на изменение их потенциальной энергии взаимодействия, на разрыв связей между молекулами. Так продолжается до тех пор, пока вся жидкость не превратится в пар. Это состояние на диаграммах обозначено двумя штрихами ('').
. Энтропия жидкости также будет возрастать. Давление жидкости, очевидно, останется постоянным ввиду подвижности поршня и постоянства внешней нагрузки. Процесс нагрева будет продолжаться до некоторого состояния, обозначенного на диаграммах одним штрихом ('). Начиная с этого момента, дальнейший подвод теплоты не приводит больше к изменению температуры в цилиндре. Начинается фазовый переход – превращение жидкости в пар. Но не вся жидкость мгновенно переходит в пар, количество жидкости, превратившейся в пар, оказывается пропорциональным подведенному с начала кипения количеству теплоты. Поршень теперь заметно поднимается вверх, так как удельный объем пара значительно выше удельного объема жидкости. Физически постоянство температуры во время фазового перехода при постоянном давлении объясняется тем, что в этом случае энергия, подведенная к жидкости извне в форме теплоты, тратится не на увеличение кинетической энергии молекул жидкости (пропорциональной температуре), а на изменение их потенциальной энергии взаимодействия, на разрыв связей между молекулами. Так продолжается до тех пор, пока вся жидкость не превратится в пар. Это состояние на диаграммах обозначено двумя штрихами ('').
Двухфазное состояние "жидкость-пар" носит название состояния насыщения, а температура и давление такого состояния называются параметрами насыщения 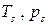 . Равновесная смесь жидкости и пара в состоянии насыщения называется влажным паром. Пар в состоянии (") называется сухим насыщенным. При дальнейшем подводе тепла внешняя энергия будет вновь затрачиваться на интенсификацию хаотического движения молекул, т.е. температура пара будет возрастать. Такой пар с температурой, превышающей температуру насыщения, называется перегретым паром. При изменении внешнего давления p процесс фазового перехода происходит подобным образом с тем отличием, что с увеличением давления точки начала кипения (') смещаются в диаграммах
. Равновесная смесь жидкости и пара в состоянии насыщения называется влажным паром. Пар в состоянии (") называется сухим насыщенным. При дальнейшем подводе тепла внешняя энергия будет вновь затрачиваться на интенсификацию хаотического движения молекул, т.е. температура пара будет возрастать. Такой пар с температурой, превышающей температуру насыщения, называется перегретым паром. При изменении внешнего давления p процесс фазового перехода происходит подобным образом с тем отличием, что с увеличением давления точки начала кипения (') смещаются в диаграммах  вправо, а точки окончания кипения (") – влево. Такая ситуация имеет место до некоторого давления p кр, называемого критическим, при котором начало кипения (') и окончание кипения (") совпадают. Такое состояние называется критическим. Температура и удельный объем в критической точке также строго определены. Для воды критические параметры имеют следующие значения: p кр=221.15 бар, T кр=647.27 К=374.12оС, v кр=0.00315 м3/кг.
вправо, а точки окончания кипения (") – влево. Такая ситуация имеет место до некоторого давления p кр, называемого критическим, при котором начало кипения (') и окончание кипения (") совпадают. Такое состояние называется критическим. Температура и удельный объем в критической точке также строго определены. Для воды критические параметры имеют следующие значения: p кр=221.15 бар, T кр=647.27 К=374.12оС, v кр=0.00315 м3/кг.
Геометрическое место точек начала кипения (') в диаграммах  называется нижней пограничной кривой,а геометрическое место точек окончания кипения (") – верхней пограничной кривой (рис.6.2). Вместе они составляют просто пограничную кривую. Верхняя и нижняя ветви пограничной кривой сходятся в критической точке. Область на диаграммах
называется нижней пограничной кривой,а геометрическое место точек окончания кипения (") – верхней пограничной кривой (рис.6.2). Вместе они составляют просто пограничную кривую. Верхняя и нижняя ветви пограничной кривой сходятся в критической точке. Область на диаграммах  , ограниченная пограничной кривой, называется областью влажного пара, это область двухфазного состояния вещества. В этой области давление и температура однозначно связаны:
, ограниченная пограничной кривой, называется областью влажного пара, это область двухфазного состояния вещества. В этой области давление и температура однозначно связаны:  или
или 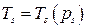 .
.
Количество теплоты, затраченное на фазовый переход при постоянных давлении и температуре может быть рассчитано на основе первого закона термодинамики для изобарного процесса и второго закона – для изотермического:
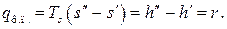
Величина r, представляющая собой количество теплоты, затраченное на превращение единицы массы кипящей жидкости в сухой насыщенный пар при постоянном давлении, носит название удельной (или скрытой) теплоты парообразования.

 Рассмотрим процесс фазового перехода «[U12] жидкость–[U13] пар». Пусть в цилиндре под поршнем находится 1 кг химически чистой, т.е. без примесей и растворенных в ней газов, жидкости, например воды (рис.6.1). Если пренебречь изменением гидростатического давления в жидкости, вызванного действием силы тяжести, то давление в жидкости будет постоянным по высоте и [U14], равным внешнему давлению p. Изобразим состояние жидкости в диаграммах
Рассмотрим процесс фазового перехода «[U12] жидкость–[U13] пар». Пусть в цилиндре под поршнем находится 1 кг химически чистой, т.е. без примесей и растворенных в ней газов, жидкости, например воды (рис.6.1). Если пренебречь изменением гидростатического давления в жидкости, вызванного действием силы тяжести, то давление в жидкости будет постоянным по высоте и [U14], равным внешнему давлению p. Изобразим состояние жидкости в диаграммах  точкой а (рис.6.2). Будем медленно (обратимо) подводить к жидкости теплоту через стенки цилиндра. Температура жидкости будет медленно возрастать, объем ее также будет увеличиваться, но чрезвычайно мало ввиду малости коэффициента
точкой а (рис.6.2). Будем медленно (обратимо) подводить к жидкости теплоту через стенки цилиндра. Температура жидкости будет медленно возрастать, объем ее также будет увеличиваться, но чрезвычайно мало ввиду малости коэффициента
 . Энтропия жидкости также будет возрастать. Давление жидкости, очевидно, останется постоянным ввиду подвижности поршня и постоянства внешней нагрузки. Процесс нагрева будет продолжаться до некоторого состояния, обозначенного на диаграммах одним штрихом ('). Начиная с этого момента, дальнейший подвод теплоты не приводит больше к изменению температуры в цилиндре. Начинается фазовый переход – превращение жидкости в пар. Но не вся жидкость мгновенно переходит в пар, количество жидкости, превратившейся в пар, оказывается пропорциональным подведенному с начала кипения количеству теплоты. Поршень теперь заметно поднимается вверх, так как удельный объем пара значительно выше удельного объема жидкости. Физически постоянство температуры во время фазового перехода при постоянном давлении объясняется тем, что в этом случае энергия, подведенная к жидкости извне в форме теплоты, тратится не на увеличение кинетической энергии молекул жидкости (пропорциональной температуре), а на изменение их потенциальной энергии взаимодействия, на разрыв связей между молекулами. Так продолжается до тех пор, пока вся жидкость не превратится в пар. Это состояние на диаграммах обозначено двумя штрихами ('').
. Энтропия жидкости также будет возрастать. Давление жидкости, очевидно, останется постоянным ввиду подвижности поршня и постоянства внешней нагрузки. Процесс нагрева будет продолжаться до некоторого состояния, обозначенного на диаграммах одним штрихом ('). Начиная с этого момента, дальнейший подвод теплоты не приводит больше к изменению температуры в цилиндре. Начинается фазовый переход – превращение жидкости в пар. Но не вся жидкость мгновенно переходит в пар, количество жидкости, превратившейся в пар, оказывается пропорциональным подведенному с начала кипения количеству теплоты. Поршень теперь заметно поднимается вверх, так как удельный объем пара значительно выше удельного объема жидкости. Физически постоянство температуры во время фазового перехода при постоянном давлении объясняется тем, что в этом случае энергия, подведенная к жидкости извне в форме теплоты, тратится не на увеличение кинетической энергии молекул жидкости (пропорциональной температуре), а на изменение их потенциальной энергии взаимодействия, на разрыв связей между молекулами. Так продолжается до тех пор, пока вся жидкость не превратится в пар. Это состояние на диаграммах обозначено двумя штрихами ('').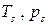 . Равновесная смесь жидкости и пара в состоянии насыщения называется влажным паром. Пар в состоянии (") называется сухим насыщенным. При дальнейшем подводе тепла внешняя энергия будет вновь затрачиваться на интенсификацию хаотического движения молекул, т.е. температура пара будет возрастать. Такой пар с температурой, превышающей температуру насыщения, называется перегретым паром. При изменении внешнего давления p процесс фазового перехода происходит подобным образом с тем отличием, что с увеличением давления точки начала кипения (') смещаются в диаграммах
. Равновесная смесь жидкости и пара в состоянии насыщения называется влажным паром. Пар в состоянии (") называется сухим насыщенным. При дальнейшем подводе тепла внешняя энергия будет вновь затрачиваться на интенсификацию хаотического движения молекул, т.е. температура пара будет возрастать. Такой пар с температурой, превышающей температуру насыщения, называется перегретым паром. При изменении внешнего давления p процесс фазового перехода происходит подобным образом с тем отличием, что с увеличением давления точки начала кипения (') смещаются в диаграммах  или
или 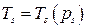 .
.